Аккумуляторная батарея как работает: Что такое АКБ — принцип работы, термины, история изобретения
- 06.07.2019
Как работает аккумуляторная батарея
Странно, но факт, что некоторые изобретения человечества были получены очень необычными способами. Однажды, взяв лягушку и подвесив её на верёвочке, учёный по имени Луиджи Гальвани заметил, что если поднести две металлические пластины (из разных металлов) к лягушке и коснуться ими её, то лягушачья лапка начинает дергаться! Невероятный опыт.
И не менее фантастическое изобретение было получено, в конце концов. Аккумуляторы — наша новая тема! Расскажу коротко историю развития и современное применение столь нужного устройства!
Аккумулятор — это устройство для накопления энергии. Цель — её дальнейшее использование. Слово «altilium» латинское и переводится как «накопитель». Бывают: электро, тепловые, инерционные, гидравлические и т.д. Наш разговор пойдёт о первом виде. Устройство, накапливающее электрическую энергию.
Схема аккумулятора простая. В электролит погружены электроды с разной полярностью.
Как всё начиналось
Кстати, пытливый ум учёного Гальвани оказался не прав. Он ошибочно решил, что сама лягушка вырабатывает энергию, и даже успел назвать это не иначе как «животное электричество». На благо человечества был ещё один учёный-физик с фамилией Вольта, который установил ошибочность опыта. Алессандро Вольта доказал, что ток возникает в результате химической реакции между пластинами из разных металлов.
В 1800 году физик Вольта проводил опыты с разными металлами. В качестве положительного электрода использовал олово, цинк, свинец или железо. Отрицательным были — медь, золото и серебро. В итоге сочетание цинк-медь, помещённые в соляной раствор, явили миру первый химический источник тока. Странно, но эффект получения энергии подобным способом назвали «гальванизм».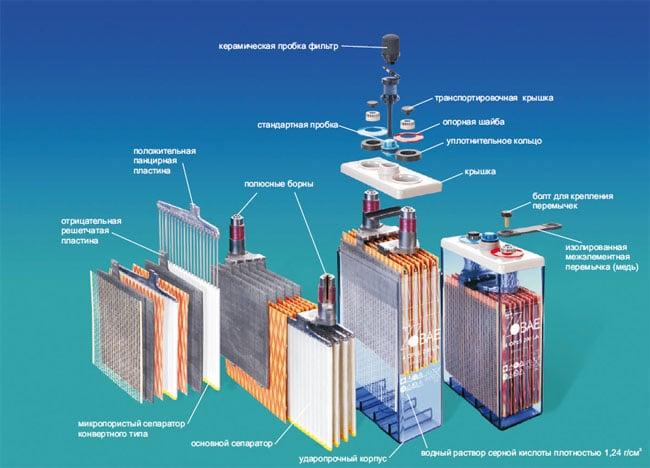 Первая батарейка стала «гальваническим элементом».
Первая батарейка стала «гальваническим элементом».
Первая серийная батарея была просто «шедевральной». Представьте, деревянная коробка, внутри которой расположены медные и цинковые пластины. Всё это залито морской водой, выступающей в качестве электролита. Ну и последний штрих — сверху вся конструкция плотно упакована в цемент. К сожалению, перезарядка таких устройств не осуществлялась.
Первый настоящий аккумулятор был получен лишь в 1859 году. Это модель, принципы которой и сейчас актуальны. Свинцовые пластины, ткань и дерево. В 1899 году был изготовлен первый никель-кадмиевый аккумулятор, а в 1901 году — никель-железный.
Современные реалии
Про сегодняшний мир аккумуляторов я расскажу на примере источников питания мобильных устройств — телефонов, смартфонов, ноутбуков, камер и источников бесперебойного питания. Хотя, если брать последние модели, технология и материалы у всех одни. Коротко о том, где используются, плюсах и минусах.
Современные электрохимические системы подразделяются на:
Свинцово-кислотные, герметичные (SLA)
Применяются такие батареи обычно там, где вес и размеры не имеют значения (или почти не имеют).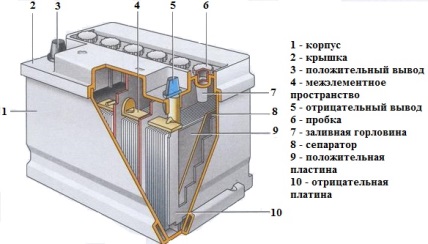
Никель-кадмиевые (Ni-Cd)
Используются эти элементы в медицинском оборудовании, ручном электроинструменте, радиостанциях, в старых моделях сотовых, радиотелефонах, видеокамерах.
Преимущества — быстрый заряд и способность отдавать большой ток. Не нагревается при эксплуатации. Длительный срок службы при правильном использовании. Низкая цена.
Минусы — «эффект памяти» и высокий саморазряд. Приличный вес. Содержание кадмия требует особой утилизации. Но когда это нас пугало.
Никель-металлгидритные (Ni-MH)
Эти системы призваны заменить никель-кадмиевые элементы. Плотность энергии у них больше, тем самым аккумуляторы намного легче. Отсутствует «эффект памяти» (почти), но имеет место нагрев батареи. Экологически безопасны. Если коротко и честно, то минусов больше, чем плюсов. Но маркетологи пытаются рассказать обратное.
Но маркетологи пытаются рассказать обратное.
Литий-ионные (Li-ion)
Все современные смартфоны, ноутбуки и любые другие гаджеты, используют эту технологию сегодня. Такие виды батарей вытеснили всех остальных по ряду веских причин.
Плюсы — маленький вес и размер, высокая плотность заряда, отсутствие «памяти». Низкий саморазряд и не надо обслуживать. Встроенная система защиты и схема управления.
Недостатки — высокая цена, «нелюбовь» к полной разрядке, небольшой срок эксплуатации (максимум 2 года).
Литий-полимерные (Li-Pol)
Одна из последних разработок в области сохранения энергии. Вместо электролита тут используется полимер. Имеет все преимущества литий-ионной батареи. Большим плюсом является тот факт, что батарею можно сделать любой толщины и формы. Согласитесь, это круто! Минус — может неплохо бабахнуть при неправильной эксплуатации.
Хочу заметить, что именно в таком порядке смены электрохимических систем развивалась данная технология. Аккумуляторы продолжают совершенствоваться, и, думаю, резкий прорыв не за горами. Также даю несколько нужных советов в использовании ваших устройств, имеющих батареи:
Аккумуляторы продолжают совершенствоваться, и, думаю, резкий прорыв не за горами. Также даю несколько нужных советов в использовании ваших устройств, имеющих батареи:
- Современные аккумуляторы не надо полностью разряжать и потом заряжать. Лучший период для зарядки — 40-80%.
- Больше всех «жрёт» батарею — экран. Хотите сэкономить — убавляйте яркость.
- Нельзя оставлять на ночь на зарядке — это миф! Оставляйте смело!
- Холод и жара реально вредят батарее. Старайтесь не мыться в бане со своим смартфоном и не забывать его в холодильнике
- Использовать можно любые качественные зарядные устройства для любых гаждетов.
- Можно спокойно использовать телефон, когда он на зарядке. Хоть болтать, хоть играть.
Информация об аккумуляторных батареях ASUS
Жизненный цикл батареи
- Из-за химических свойств ионов лития емкость батареи постепенно уменьшается с течением времени.
 Это нормальное явление.
Это нормальное явление. - Срок службы литий-ионной батареи составляет примерно 300-500 циклов. При нормальных условиях использования и температуре окружающей среды (25 ℃) литий-ионный аккумулятор должен нормально разряжаться и заряжаться в течение 300 циклов (или около одного года). После этого емкость аккумулятора падает до 80% от первоначальной.
- Снижение срока службы батареи зависит от конструкции системы, модели, энергопотребления системы, потребления программ и операционного программного обеспечения, а также настроек управления питанием. Высокие / низкие рабочие температуры и ненормальная работа могут привести к быстрому сокращению срока службы батареи на 60% или более за короткое время.
- Скорость разряда аккумулятора зависит от программного обеспечения ноутбука или планшета и настроек управления питанием. Например, выполнение требовательных к вычислениям программ, таких как графическое программное обеспечение, игровое программное обеспечение и воспроизведение видео, потребляет больше энергии, чем выполнение обычного программного обеспечения для обработки текстов.

Механизмы защиты аккумулятора
*Емкость инициирования заряда батареи (%) обычно устанавливается между 90% -99%. Фактическое значение будет отличаться в зависимости от модели.
- Аккумуляторы, заряженные или хранящиеся при высоких температурах окружающей среды, могут повредиться и ускорить сокращение срока службы батареи. Когда температура батареи слишком высокая и аккумулятор перегревается, зарядная емкость батареи будет ограничена или прекращена совсем. Это часть механизмов защиты батареи системы.

- Несмотря на то, что устройство было выключено, а адаптер переменного тока удален, системе по-прежнему требуется небольшое энергопотребление, поэтому это нормальный сценарий, когда уровень заряда батареи все еще падает.
Износ аккумулятора
- Батареи по сути это расходные материалы. Литий-ионные аккумуляторы с непрерывными химическими реакциями естественным образом разряжаются и теряют емкость.
- После использования аккумулятора в течение некоторого времени, при определенных условиях аккумулятор может незначительно вздуться. Это не создаст проблем безопасности.
- Вздутые батареи должны быть заменены и выброшены должным образом, даже если они не влияют на безопасность. При замене вздувшихся батарей не выбрасывайте старую батарею в бытовые отходы. Обратитесь в местную службу поддержки ASUS для утилизации батарей.
Стандартный уход за аккумулятором
- Если ноутбук, мобильный телефон или планшет не будут использоваться в течение длительного времени, зарядите аккумулятор до 50%, выключите устройство и отсоедините источник питания переменного тока (адаптер).
 Подзаряжайте аккумулятор каждые три месяца до 50%, чтобы предотвратить повреждение аккумулятора из-за чрезмерной разрядки из-за длительного хранения без использования.
Подзаряжайте аккумулятор каждые три месяца до 50%, чтобы предотвратить повреждение аккумулятора из-за чрезмерной разрядки из-за длительного хранения без использования. - Когда источник питания переменного тока постоянно используется для ноутбука, мобильных телефонов или планшетов, пользователь должен разряжать аккумулятор до 50% не реже одного раза в две недели, чтобы освободить аккумулятор от постоянного высокого напряжения, что может сократить срок его службы. Пользователи ноутбуков могут продлить срок службы батареи с помощью программного обеспечения ASUS Battery Health Charging.
- Наилучшими условиями хранения аккумуляторов являются температура окружающей среды от 10 до 35 ° C, поддержание заряда на уровне 50% и увеличение срока службы батареи с помощью программного обеспечения ASUS Battery Health Charging.
- Избегайте хранения батарей во влажной среде, которая может привести к увеличению скорости разряда батареи. Среда с более низкой температурой будет вредить внутренним химическим веществам батареи, в то время как батареи, хранящиеся при более высокой температуре, подвергаются риску взрыва.

- Не размещайте компьютер, мобильный телефон или аккумулятор рядом с радиаторами, каминами, печами, электронагревателями или другими источниками тепла выше 60 ℃ (140 ° F). Перегрев аккумулятора может привести к его взрыву или протечке, что может привести к возгоранию.
- Поскольку в ноутбуках используется встроенный аккумулятор, аккумулятор не будут получать питания, если компьютер не использовался или не заряжался, а затем время и настройки BIOS вернутся к значениям по умолчанию. Если вы не собираетесь использовать компьютер в течение длительного времени, заряжайте аккумулятор раз в месяц.
Оптимальные настройки Батареи
Держа адаптеры переменного тока подключенными к ноутбукам, сотовым телефонам или планшетам во время использования, аккумуляторы остаются слишком заряженными, что может сократить срок их службы. Чтобы защитить аккумулятор при таком использовании, пользователи ноутбука могут продлить срок его службы с помощью программного обеспечения ASUS Battery Health Charging.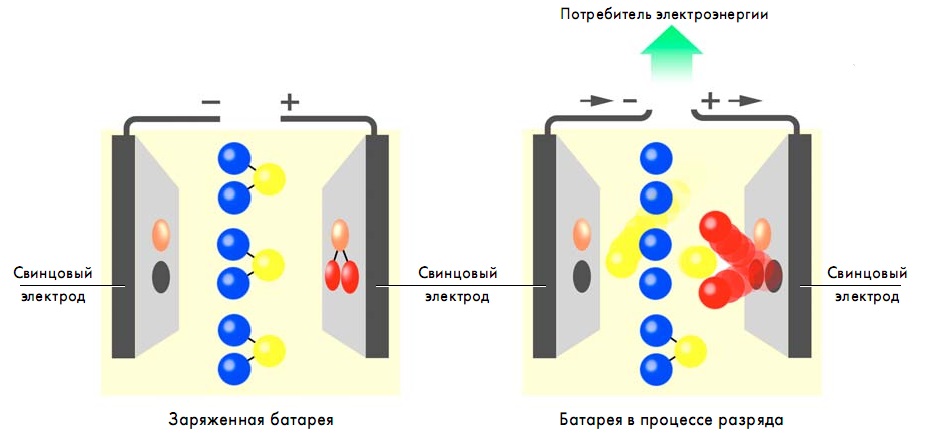
Введение ASUS Battery Health Charging
https://www.asus.com/ru/support/FAQ/1032726/
Поставки моделей с 4 квартала 2017 содержат это приложение.
Условия гарантии на аккумуляторы ASUS
- ASUS заменит новую аккумуляторную батарею в следующих случаях (применяются условия гарантии https://www.asus.com/ru/support/Article/606/):
- (a) батарея не заряжается;
- (b) батарея вызывает самопроизвольное включение/выключение/перезагрузку ноутбука;
- (c) батарея быстро разряжается;
- (d) батарея не определяется системой;
- (e) система неоднократно предупреждает пользователя о необходимости замены батареи;
- (f) индикатор зарядки батареи работает некорректно;
Обзор аккумуляторов ASUS
Литий-ионные батареи
Преимущества литий-ионных аккумуляторов включают высокую плотность энергии, большую емкость, малый вес, длительный срок службы, отсутствие эффекта памяти и быструю зарядку. Они широко используются в потребительских товарах, таких как мобильные телефоны, ноутбуки и планшеты.
Они широко используются в потребительских товарах, таких как мобильные телефоны, ноутбуки и планшеты.
Как правильно заряжать аккумулятор? Зарядка аккумулятора | Заряд аккумуляторной батареи герметичной необслуживаемой
Правильная зарядка аккумулятора
Одним из наиболее важных условий корректной работы, хорошей отдачи и длительного срока службы аккумуляторной батареи является её правильный заряд. Это касается абсолютно всех аккумуляторов: будь то мощные промышленные большой емкости, либо же крошечные батарейки в Ваших мобильных. К сожалению, далеко не все пользователи знают, что есть правильная зарядка аккумулятора. Данная статья призвана помочь людям в этом вопросе и быть «руководством пользователя» при столкновении с задачей должным образом зарядить АКБ (аккумуляторную батарею).
Существует множество различных видов электрических аккумуляторов – для каждого из них характерны свои правила и особенности заряда. Все они подробно описаны в инструкциях по эксплуатации, обязательным образом поставляемых продавцом (по крайней мере мы так делаем всегда) вместе с аккумуляторной продукцией. Однако, бороздить инструкцию в поиске нужной информации не всегда удобно, да и не всегда, согласитесь, есть к тому желание. Посему, в данной статье мы обрисуем общие правила по правильной зарядке наиболее популярных и часто используемых в бытовых условиях аккумуляторов – свинцово-кислотных необслуживаемых герметичных АКБ (чаще всего это аккумуляторы для ИБП, аккумуляторы для электромобилей, электромоторов, для лодок, эхолотов, для сигнализации и связи и проч.) – AGM и гелевых аккумуляторов. Эти правила кое в чем справедливы и для автомобильных стартерных (обслуживаемых) АКБ, хоть процесс заряда таких аккумуляторов и имеет некоторые особенности.
Все они подробно описаны в инструкциях по эксплуатации, обязательным образом поставляемых продавцом (по крайней мере мы так делаем всегда) вместе с аккумуляторной продукцией. Однако, бороздить инструкцию в поиске нужной информации не всегда удобно, да и не всегда, согласитесь, есть к тому желание. Посему, в данной статье мы обрисуем общие правила по правильной зарядке наиболее популярных и часто используемых в бытовых условиях аккумуляторов – свинцово-кислотных необслуживаемых герметичных АКБ (чаще всего это аккумуляторы для ИБП, аккумуляторы для электромобилей, электромоторов, для лодок, эхолотов, для сигнализации и связи и проч.) – AGM и гелевых аккумуляторов. Эти правила кое в чем справедливы и для автомобильных стартерных (обслуживаемых) АКБ, хоть процесс заряда таких аккумуляторов и имеет некоторые особенности.
Как заряжать аккумулятор?
Итак, давайте разберемся, что представляет из себя правильный заряд аккумуляторной батареи. Для начала хотим обратить внимание на одно общее правило, касающееся ВСЕХ БЕЗ ИСКЛЮЧЕНИЯ видов аккумуляторов, известных науке: чем меньше раз разряжается аккумулятор и чем менее глубоким является каждый отдельно взятый его разряд, тем большим будет срок его службы. Все мифы о том, что аккумулятор (какой бы он ни был!), нужно каждый раз полностью разряжать, а затем полностью заряжать, и только так он прослужит максимально долго, а также утверждения «знатоков», что, мол, надо обязательно периодически разряжать аккумулятор, иначе он испортится – полная чушь! Если Вам предлагают купить аккумулятор и при этом рассказывают подобные «истории» – держитесь от таких продавцов и их продукции подальше. Для низкокачественных батарей, производимых из «грязного» вторсырья, отсутствие периодической «встряски» в виде разряда-заряда может действительно быть причиной быстрого выхода из строя (из-за того, что пластины данных АКБ чрезмерно загрязнены, и без «встрясок» данная «грязь» быстро обволакивает поверхность пластин и мешает нормальному прохождению процесса электролиза). Но для качественных аккумуляторов наиболее излюбленным является именно режим постоянного (буферного) подзаряда, при котором практически отсутствуют разряды, а сама АКБ постоянно пребывает под правильным напряжением.
Все мифы о том, что аккумулятор (какой бы он ни был!), нужно каждый раз полностью разряжать, а затем полностью заряжать, и только так он прослужит максимально долго, а также утверждения «знатоков», что, мол, надо обязательно периодически разряжать аккумулятор, иначе он испортится – полная чушь! Если Вам предлагают купить аккумулятор и при этом рассказывают подобные «истории» – держитесь от таких продавцов и их продукции подальше. Для низкокачественных батарей, производимых из «грязного» вторсырья, отсутствие периодической «встряски» в виде разряда-заряда может действительно быть причиной быстрого выхода из строя (из-за того, что пластины данных АКБ чрезмерно загрязнены, и без «встрясок» данная «грязь» быстро обволакивает поверхность пластин и мешает нормальному прохождению процесса электролиза). Но для качественных аккумуляторов наиболее излюбленным является именно режим постоянного (буферного) подзаряда, при котором практически отсутствуют разряды, а сама АКБ постоянно пребывает под правильным напряжением.
Здесь надо учитывать также эффект памяти некоторых аккумуляторных батарей — в настоящий момент под эффектом памяти понимается обратимая потеря ёмкости, имеющая место в некоторых типах электрических аккумуляторов при нарушении рекомендованного режима зарядки, в частности, при подзарядке не полностью разрядившегося аккумулятора. Название связано с внешним проявлением эффекта: аккумулятор как будто «помнит», что в предыдущие циклы работы его ёмкость не была использована полностью, и при разряде отдаёт ток только до «запомненной границы». Никель-металл-гидридный (Ni-MH), Никель-кадмиевый (NiCd), Серебряно-цинковый аккумулятор.
Переходим ближе к делу. Чтобы правильно заряжать аккумулятор нужно понимать, в каком режиме он у Вас эксплуатируется.
Что такое буферный режим работы
Самый яркий пример буферного режима работы аккумулятора – ИБП (источник бесперебойного питания, он же UPS). В ИБП аккумуляторная батарея находится на постоянной подзарядке и отдает энергию лишь тогда, когда пропадает электричество в сети, а как только оно появляется, аккумулятор тут же подзаряжается.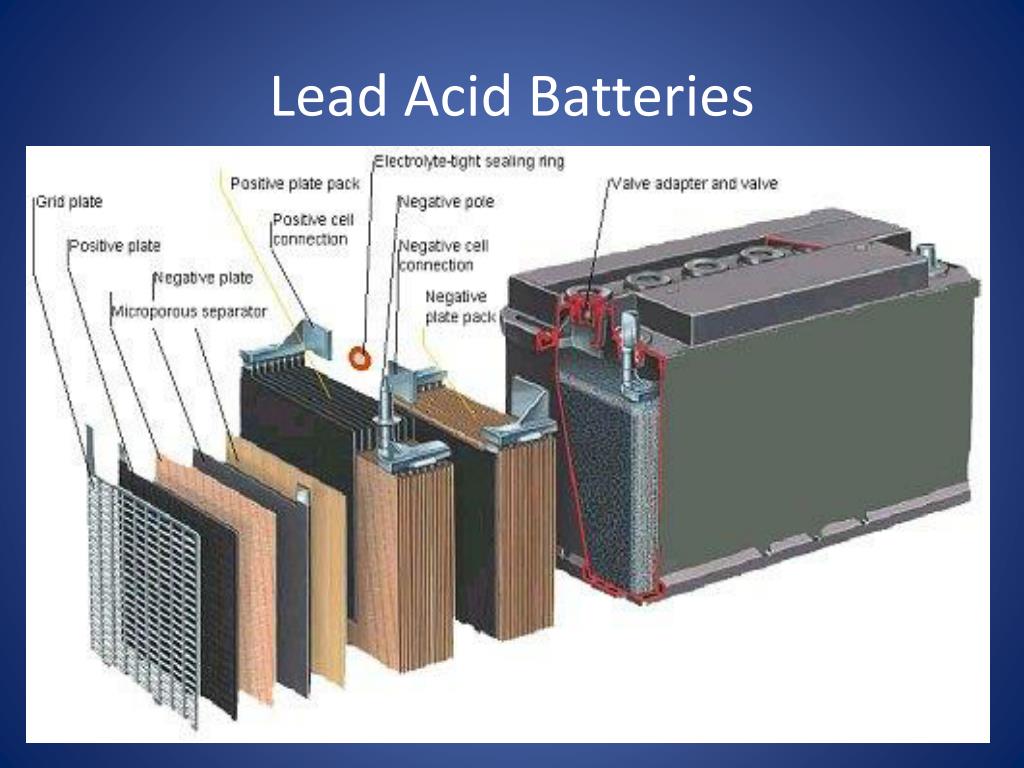 Это самый щадящий режим работы и именно в буферном режиме, как мы уже говорили, аккумуляторы служат дольше всего (например, наши батареи EverExceed серии ST, производимые по технологии AGM нового поколения, имеют срок службы в буферном режиме при Т=20оС – 12 лет).
Это самый щадящий режим работы и именно в буферном режиме, как мы уже говорили, аккумуляторы служат дольше всего (например, наши батареи EverExceed серии ST, производимые по технологии AGM нового поколения, имеют срок службы в буферном режиме при Т=20оС – 12 лет).
Что такое циклический режим работы
Пример циклического режима использования АКБ – поломоечная машина, детский электромобиль в парке аттракционов, либо же система автономного электропитания с использованием альтернативных источников энергии (солнечных батарей, ветряков и т.д.). Аккумуляторы в этих приложениях разряжают-заряжают как минимум 1 раз в сутки. Такой режим является наиболее суровым, и срок службы АКБ тут уже исчисляется не годами, а количеством циклов разряд-заряда (ну и их глубины, естественно). Упомянутые ранее аккумуляторы EverExceed серии ST могут обеспечить до 600 циклов глубокого 100% разряда (обычные же AGM-аккумуляторы – не более 280). Всегда очень удивляет, когда в приложениях с явно циклическим характером работы (те же системы электропитания на солнечных батареях, либо мобильные кофемашины) некоторые «умельцы» предлагают использование стартерных автомобильных аккумуляторов (аргумент – их дешевизна!). Уведомляем всех, кто столкнулся с подобным предложением: стартерные АКБ имеют тонкие пластины, они рассчитаны лишь на запуск двигателя и дальнейшую подзарядку от генератора, в циклическом же режиме с глубокими разрядами они не прослужат и пары месяцев – их пластины «посыпятся» и на этом эксперемент с «дешевым аналогом» будет завершен.
Уведомляем всех, кто столкнулся с подобным предложением: стартерные АКБ имеют тонкие пластины, они рассчитаны лишь на запуск двигателя и дальнейшую подзарядку от генератора, в циклическом же режиме с глубокими разрядами они не прослужат и пары месяцев – их пластины «посыпятся» и на этом эксперемент с «дешевым аналогом» будет завершен.
Как правильно заряжать аккумулятор в буферном режиме:
Всем известно, что номинальное напряжение одного элемента в свинцово-кислотных АКБ = 2 Вольта (отметим, что на практике оно обычно никогда не равняется строго 2 В, но для простоты применяется именно такое число). В быту наиболее часто используются аккумуляторные батареи напряжением 6 Вольт (3 элемента) и 12 Вольт (6 элементов).
В буферном режиме напряжение заряда следует выставить на уровне 2,27 – 2,30 Вольт на элемент (то есть для 12-вольтового аккумулятора это 13,6 – 13,8 В, а для 6-вольтового – 6,8 – 6,9 В). Это подходит как для AGM, так и для гелевых батарей..jpg)
Ток заряда должен быть ограничен в величину, равную 30% от номинальной 10-часовой емкости аккумулятора, выраженную в Амперах (для гелевых аккумуляторов – 20%). Например, для батареи с емкостью С10=100 Ач ограничение тока заряда должно составлять 30 А (для гелевых АКБ – 20 А).
Как правильно заряжать аккумулятор в циклическом режиме:
Напряжение заряда:
2,4 – 2,45 В/эл. (14,4 – 14,7 В на 12-вольтовую батарею или 7,2 – 7,35 В на 6-вольтовую) – для AGM-аккумуляторов;
2,35 В/эл (14,1 В на 12-вольтовую батарею или 7,05 В на 6-вольтовую) – для гелевых аккумуляторов.
Ток заряда:
20% от С10 (для батареи емкостью 100 Ач – это 20 А).
Сколько должен длиться заряд батареи
Продолжительность заряда зависит от изначальной заряженности (разряженности) батареи. Поначалу идет быстрый заряд (бустерный), но по мере насыщения потребляемый ток снижается, доходя до минимума при достижении полной заряженности АКБ. Критерий полной заряженности – падение тока, который принимает аккумулятор, до 2 – 3 мА на каждый Ач емкости батареи (при буферном заряде). Например, для той же С10=100 Ач батареи падение тока зарядки до 200 – 300 мА будет означать, что батарея почти полностью заряжена. Чтобы довести уровень заряда АКБ до 100%, следует продолжать зарядку таким милли-током еще около 1 часа. Обычно, полностью разряженная батарея заряжается за 10 часов в циклическом режиме или за 30-48 часов в буферном.
Критерий полной заряженности – падение тока, который принимает аккумулятор, до 2 – 3 мА на каждый Ач емкости батареи (при буферном заряде). Например, для той же С10=100 Ач батареи падение тока зарядки до 200 – 300 мА будет означать, что батарея почти полностью заряжена. Чтобы довести уровень заряда АКБ до 100%, следует продолжать зарядку таким милли-током еще около 1 часа. Обычно, полностью разряженная батарея заряжается за 10 часов в циклическом режиме или за 30-48 часов в буферном.
Следует учесть, что для полной зарядки аккумуляторной батареи ей следует сообщить примерно на 20% энергии больше, чем следует из понятия “номинальная емкость”. Это, как говорится, законы природы, и они едины для всех свинцово-кислотных да и других батарей, независимо от вида и производителя. Образно говоря, если батарею не «перенасытить», в ней не завершатся должные электрохимические процессы и дальнейшая отдача будет меньше.
Производить зарядку аккумуляторных батарей желательно при температуре окружающей среды 20 – 25оС.
При меньшей температуре заряжать необходимо более длительное время. Зарядка аккумулятора при температуре менее 0оС становится крайне нежелательной (ибо почти безрезультатна). Желательно также наличие функции термокомпенсации (изменения напряжения заряда в зависимости от температуры окружающей среды) на Вашем зарядном устройстве.
Таблица с основными параметрами правильной зарядки аккумуляторной батареи
| БУФЕРНЫЙ РЕЖИМ | ЦИКЛИЧЕСКИЙ РЕЖИМ |
Напряжение заряда | Для 12-в АКБ: 13,6-13,8 В Для 6-в АКБ: 6,8-6,9 В | Для 12-в АКБ: 14,4-14,7 В Для 6-в АКБ: 7,2-7,35 В |
Ток заряда (не более!) | 30% от емкости C10 (для гелевых АКБ – 20%) | 20% от емкости C10 |
Предположительность заряда | 30-48 часов | 10-12 часов |
Критерий заряженности | Падение потребляемого тока до 2-3 мА/Ач + еще 1 час заряда таким током. | Падение потребляемого тока до 8-10 мА/Ач + еще 1 час заряда таким током |
Также даем ответ на вопрос пользователья по поводу режимов заряда «BULK», «ABSORBTION» и «FLOAT«, присутствующих в некоторых ЗУ с интеллектуальной системой заряда:
- В режиме BULK идет зарядка постоянным током, при этом напряжение на аккумуляторе постоянно растет до значения 2,4-2,45 В/эл;
- В режиме ABSORPTION достигается максимальное напряжение, которое поддерживается постоянным, в то время как ток зарядки падает;
- В режиме FLOAT напряжение плавно снижается до буферного (2,27В/эл.), ток остается минимальным. Это есть режим СОДЕРЖАНИЯ аккумулятора.
Выравнивающий заряд применяется, когда есть значительный разброс по напряжению на аккумуляторах (элементах или моноблоках) – более +/- 1%. Но такое бывает редко, по крайней мере для приличных АКБ. Кроме того, если батарея хоть изредка включается на разряд, а потом на заряд, то разброс в какой-то степени сглаживается.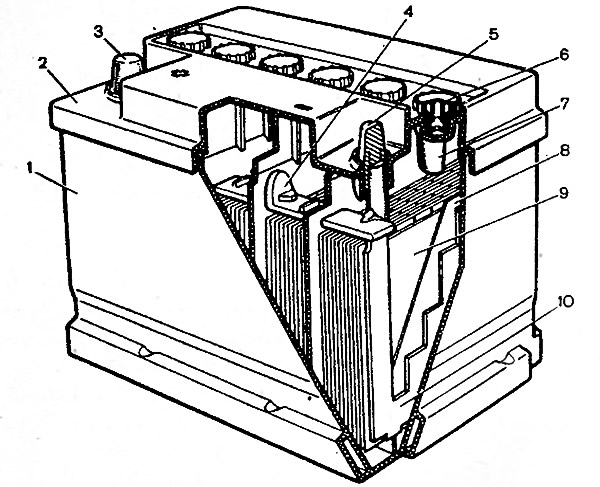 Если разброса нету – то и выравнивающий заряд производить нет смысла.
Если разброса нету – то и выравнивающий заряд производить нет смысла.
Более подробная информация по правильному заряду конкретных видов аккумуляторных батарей содержится в инструкциях по эксплуатации.
Пульсар Лимитед – Энергия для Лучшей Жизни!
Замерзают ли аккумуляторы? Как влияют климатические условия на аккумулятор?
Да, аккумуляторы замерзают.
Температура замерзания полностью заряженного аккумулятора составляет от — 50 до -70 градусов. То ест. В обычных условиях заряженные аккумуляторы не замерзают. Однако, разряженные аккумуляторы, в зависимости от уровня разрядки могут замерзать даже при температуре от до -10 градусов. На состояние зарядки аккумуляторов в частности необходимо обращать внимание при холодной погоде.
Влияние погодных условий на аккумулятор:
Да, аккумуляторы замерзают.
Температура замерзания полностью заряженного аккумулятора составляет от — 50 до -70 градусов. То ест. В обычных условиях заряженные аккумуляторы не замерзают. Однако, разряженные аккумуляторы, в зависимости от уровня разрядки могут замерзать даже при температуре от до -10 градусов. На состояние зарядки аккумуляторов в частности необходимо обращать внимание при холодной погоде.
То ест. В обычных условиях заряженные аккумуляторы не замерзают. Однако, разряженные аккумуляторы, в зависимости от уровня разрядки могут замерзать даже при температуре от до -10 градусов. На состояние зарядки аккумуляторов в частности необходимо обращать внимание при холодной погоде.
Влияние погодных условий на аккумулятор:
1. При складировании и хранении:
Запрещается хранить аккумуляторы в закрытых помещениях. При хранении на открытом воздухе, пыль и осадки увеличивают риск саморазрядки аккумулятора. Хранить аккумуляторы следует по возможности в сухих и прохладных помещениях. Уровень разрядки аккумуляторов увеличивается или уменьшается параллельно температуре. Обычно, на каждые 10 градусов повышения температуры, потеря увеличивается в два раза. Поэтому, лучше хранить аккумуляторы при температуре 10-16 градусов, чем 25-30 градусов.
2. При работе в автомобиле:
В жаркую погоду стартовая сила аккумулятора повышается, но вместе с тем повышается и коррозия (износ). Поэтому, срок службы аккумуляторов, используемых в жарких климатических условиях, ниже. В холодных климатических условиях стартовая сила аккумулятора понижается. Вдобавок к этому, для запуска двигателя холодных условиях требуется больше энергии. Как результат, в холодных условиях стартовая сила аккумулятора приобретает значение. При очень холодной погоде имеется риск замерзания жидкости (электролита) в аккумуляторе. Полностью заряженный аккумулятор замерзает при температуре -70 градусов, а аккумулятор с низким уровнем заряда может замерзнуть даже при температуре -5 градусов. Поэтому, в холодное время очень важно, чтобы аккумулятор имел хороший уровень заряда.
Поэтому, срок службы аккумуляторов, используемых в жарких климатических условиях, ниже. В холодных климатических условиях стартовая сила аккумулятора понижается. Вдобавок к этому, для запуска двигателя холодных условиях требуется больше энергии. Как результат, в холодных условиях стартовая сила аккумулятора приобретает значение. При очень холодной погоде имеется риск замерзания жидкости (электролита) в аккумуляторе. Полностью заряженный аккумулятор замерзает при температуре -70 градусов, а аккумулятор с низким уровнем заряда может замерзнуть даже при температуре -5 градусов. Поэтому, в холодное время очень важно, чтобы аккумулятор имел хороший уровень заряда.
Выбираем аккумулятор (часть 2) — Greenworks Russia
В современном мире гаджетов сложно кого-то удивить новым типом телефона или часов. Но беспроводные технологии так плотно укрепившиеся в мире портативных устройств, в садовом инвентаре и инструментах появились относительно недавно и являются новинкой на рынке садовой техники. Все больше людей отдают предпочтение аккумуляторной садовой технике благодаря ее неоспоримым преимуществам. И все покупатели чаще задаются вопрос как правильно подойти к выбору того или иного устройства. Для правильного выбора именно аккумуляторной техники необходимо в первую очередь на сам аккумулятор, какими характеристиками он обладает, ведь именно батарея будет является основой вашего инструмента.
Сегодня мы постараемся ответить на вопрос, как правильно выбрать аккумулятор, а также вкратце осветим преимущества аккумуляторов GreenWorks и расскажем почему именно наши батареи являются одними из лучших. Для того чтобы понять все преимущества нашей батареи необходимо определить основные параметры.
Основные параметры:
- Срок службы (количество циклов заряда-разряда).
- Совместимость аккумулятора (Один аккумулятор для всех устройств).
- Время автономной работы.
- Время зарядки.
- Напряжение аккумулятора
Срок службы:
Основным параметром аккумулятора при покупке, на который необходимо обратить внимание, должен быть срок его службы, а точнее какое количество циклов заряда-разряда способен выдержать аккумулятор без существенного снижение емкости. Чем дольше служит аккумулятор, тем дольше Вам не придется тратить деньги на покупку новых, и задумываться о смене устройств. Количество циклов зависит от множества нюансов. Благодаря качественным комплектующим аккумуляторы GreenWorks способны выдержать до 2000 циклов, что в случае применения аккумулятора в бытовом режиме срок службы составит 10 лет. Таким образом вы можете не боятся, что аккумулятор потеряет свои свойства через год использования и смело приобретать дополнительные устройства к уже имеющимся аккумулятора, что существенно сэкономит ваши деньги.
Совместимость аккумулятора:
Вторым по важности параметром является его совместимость. Чем больше устройств подходят для использования с купленным Вами аккумулятором — тем меньше денег Вам придется тратить в случае необходимости приобретения новой техники. Допустим Вы приобрели аккумуляторную косилку, но аккумулятор от данной косилкой не совместим больше ни с каким устройством, кроме самой косилки. Вам понадобилась цепная пила и Вы захотели приобрести цепную пилу — Вам снова придется покупать пилу вместе с еще одним аккумулятором, и тратить больше денег. В случае с техникой Greenworks, Вы имеет «арсенал» из более чем 15 или 20 устройств (в зависимости от серии), которые способны удовлетворить большинство потребностей обладателя загородного участка и позволяет пользоваться одним аккумулятором для всех устройств.
Время автономной работы:
Автономность от розетки — отличительная особенность беспроводной техники. К сожалению, нельзя дать универсальный ответ на вопрос сколько времени будет работать аккумулятор. Время автономной работы зависит от двух параметров — емкость батарей и устройства с котором она используется. Емкость аккумуляторов определяется в Ампер часах или Ватт часах, соответственно, чем выше емкость батарей, тем дольше она работает. Разная техника имеет разное энергопотребление, а также для некоторой техники невозможно определить время автономной работы в часах, например, время автономной работы для цепной пилы правильно указывать в количестве, срезов которое она способна сделать от заряда одного аккумулятора, а для дрели это будет количество закрученных шурупов. Что касается аккумуляторов GreenWorks то они в среднем на 30% дольше работают, чем батареи конкурентов, благодаря установленной плате управления — которая балансирует расход энергии и таким образом увеличивая время автономной работы.
Время зарядки:
Еще одним важным параметром является время зарядки. Обычно мы рекомендуем приобретать два аккумулятора при первой покупки техники GreenWorks.
Зачем? — все очень просто наши аккумуляторы заряжаются быстрее чем их среднее время автономной работы. То есть пока Вы работаете с одним аккумулятором, второй успеет зарядится и Вам не придется прерывать Вашу работу, а главное это нивелирует основной страх при покупке аккумуляторной техники — нехватки времени бесперебойной автономной работы. Важно отметить что зарядные устройства профессиональных серий GreenWorks поддерживают функцию быстрой зарядки, и заряжают аккумуляторы до 2-х раз быстрее.
Напряжение:
Последним пунктом нашей статьи по правильному выбору аккумулятора является его напряжение — тут уже Вам нужно ориентироваться на собственные ощущения. Чем выше напряжение аккумулятора, тем выше сила и мощь инструмента. Важно отметить что только компания GreenWorks выпускает аккумуляторный инструмент профессионального уровня с напряжение аккумулятора до 82 Вольт, а начальные линейки имеют батареи с повышенным напряжением (24 В и 40 В) в сравнение с принятыми стандартами (18 В и 36 В).
А главное Вы можете протестировать нашу технику в фирменных магазинах и убедиться, что по мощи она не уступает бензиновым аналога, а даже превосходит их.
Вот основные параметры, на которые необходимо обращать внимание, когда покупаете аккумуляторную технику. Мы надеемся, что Вы сделаете правильный выбор, а для того чтобы Вам было его проще сделать — следите за статьями на нашем сайте, в ближайшее время мы сделаем подробный обзор аккумуляторов GreenWorks.
За предоставленную информацию
благодарим нашего партнёра Green-Battery.ru
Новый аккумулятор нужно заряжать ⚡
Любому автолюбителю известно, что необходимо время от времени обслуживать аккумуляторную батарею, установленную в транспортном средстве, но далеко не всем известно, что необходимо так же обслужить новый аккумулятор перед началом использования. Нужно ли заряжать новый автомобильный аккумулятор? Почему нужно заряжать новый аккумулятор? Сегодня мы рассмотрим этот вопрос.
В каких случаях необходимо заряжать новый аккумулятор?Многие владельцы различной техники, будь то автомобиль, мотоцикл, квадроцикл, моторная лодка, не подозревают, что новому аккумулятору может потребоваться заряд. Часто это вина некомпетентных продавцов, которые говорят, что аккумулятор был заряжен на заводе и дополнительно ничего не требуется. Безусловно, изготовитель заряжает АКБ перед отгрузкой, но прежде чем аккумуляторная батарея доберётся до вас, она ещё постоит несколько дней на складе и недель в магазине. За это время в результате саморазряда АКБ потеряет часть своего заряда и будет нуждаться в подзарядке. Конечно же, это не справедливо для тех магазинов, персонал которых регулярно обслуживает аккумуляторы перед продажей, но это так же не является достаточным условием. А если аккумулятор уже стоит на покупаемом автомобиле, мотоцикле или другой технике, и вы покупаете автомобиль в марте, выпущенный в июне прошлого года? Как вы думаете, какой был уход за этой батарей?
Необходимо узнать дату производства аккумулятора
Если новый аккумулятор шёл до вас полгода и больше, его однозначно нужно зарядить зарядным устройством перед эксплуатацией.
Несмотря на то, что допустимый срок хранения у большинства современных аккумуляторных батарей составляет один год, не рекомендуем покупать батареи, у которых с момента выпуска прошло более полугода. Срок эксплуатации кислотного аккумулятора начинается с момента залива в него электролита.
Примерно оценить уровень заряда нового аккумулятора вы сможете с помощью вольтметра.
Напряжение полностью заряженной аккумуляторной батареи составляет 12,6─12,9 вольта. Если напряжение АКБ менее 12,5 вольт, то её нужно обязательно подзарядить перед использованием. Если случай особенно запущенный и аккумуляторная батарея имеет напряжение около 11,9 вольт и ниже, то тут требуется полноценная зарядка. Но лучше отказать от покупки такого аккумулятора.
Проверка таких батарей нагрузочной вилкой не всегда является объективной, т.к. в магазине могут использовать нагрузочную вилку с нагрузочным током всего 50-70А, а тестировать ею, например, 100Ач батареи. А если этой же нагрузочной вилкой протестировать батарею в 60Ач – результат будет совсем другой. Поэтому стоит доверять тем магазинам, где используется хорошо зарекомендовавшие себя в отрасли тестеры тока холодной прокрутки.
К чему может привести установка не заряженного до конца аккумулятора
Как правило, большинство автолюбителей беспечно думают «поставил новый и забыл», но спустя какое-то время могут возникнуть проблемы.
- Если аккумулятор долгое время хранился не полностью заряженным (сульфатация пластин начинается, при снижении напряжения батарею уже до 12,5В), то пластины могли частично сульфатироваться (покрытие пластин сульфатом) и заряд генератора не всегда способен произвести десульфатацию (очистку пластин от сульфата).
- Не всегда генератор способен полностью зарядить аккумулятор, т.к. помимо аккумулятора, как потребителя тока в транспортном средстве, есть другие потребители тока (блоки управления, освещение, кондиционер и т.д.).
- Короткие пробеги автомобиля «до магазина» и пробки также пагубно влияют на срок жизни/службы аккумулятора.
Поэтому в эксплуатации всегда находится не дозаряженный аккумулятор. Из-за этого наступает необратимая сульфатация, которая, может развиться до короткого замыкания и, как правило, в самый не подходящий момент привести к отказу АКБ. Эта ситуация так же применима к случаям «прикуривания» автомобиля зимой. После такой операции необходимо провести полный заряд аккумулятора зарядным устройством.
Как и сколько заряжать новый автомобильный аккумулятор?
Для зарядки можно использовать зарядное устройство, которое подходит для вашего аккумулятора, с соблюдением инструкции по эксплуатации аккумулятора. Большинство современных автоматических зарядных устройств заряжают батарею без вмешательства пользователя. Поэтому в настоящее время ломать голову, как заряжать аккумулятор, не приходится.
Новый аккумулятор немного разряженВ случае если новый аккумулятор «сел» не сильно (до напряжения 12,5-6 вольт), то можно его просто подзарядить. Для этого поставьте АКБ на подзарядку любым зарядным устройством. В случае с автоматическим зарядным устройством, за Вас все сделает электроника, а с ручным – выставьте напряжение 14,4В и силу тока в зависимости от емкости аккумулятора. По мере зарядки сила тока будет снижаться до 200-300мА, после чего зарядка будет считаться оконченной.
Подзарядка такой батареи не займет много времени, т.к. батарея разряжена всего на 20-30%. После зарядки аккумулятор готов к эксплуатации. Перед зарядкой желательно вывернуть пробки из банок, при их наличии. Зарядку аккумулятора проводите в хорошо проветриваемом помещении.
Факт: Новый аккумулятор нужно заряжать ⚡
Решения по теме публикации
PL-C010PЗарядное устройство Battery Service Expert, PL-C010P
14.4/14.7/16В, ток 2,5, 6, 10А, десульфатация — импульсы/16В, SLA, GEL, AGM, Ca/Ca
8 350 ₽
Не работает аккумуляторная батарея на ноутбуке ASUS-«АСУС ИНФО»
Неисправность аккумуляторной батареи — распространенная поломка, причины которой не всегда сводятся к естественному износу. Эта проблема может свидетельствовать о более серьезных повреждениях, которые требуют срочного ремонта. Почему не заряжается аккумуляторная батарея на ноутбуке АСУС? Основные причины таковы:
- естественный износ аккумулятора;
- повреждение контактов в результате залития или сильного физического воздействия;
- короткое замыкание в цепях питания;
- выход из строя контроллера зарядки, управляющего циклами зарядки-разрядки батареи.
Кроме того, возможна ситуация, когда аккумулятор только кажется сломанным, и его замена не нужна. Если пользователь допустил полную разрядку АКБ, ноутбук не сразу отреагирует на подключение к сети. В таком случае следует подождать и обращаться к профессиональным мастерам, если спустя 15-30 минут зарядки от электросети ничего не изменилось.
Что делать, если аккумулятор ноутбука не работает?
Если система питания ноутбука дала сбои, от пользователя зависит немногое. Тем не менее, он может самостоятельно сделать первичную диагностику – попробовать подключить ноут Асус к сети без батареи, проверить состояние гнезда и провода зарядки. Если выяснится, что действительно неисправна АКБ, можно попробовать поменять аккумулятор на аналогичный. Однако целесообразно все-таки обратиться за помощью к сервисным инженерам, и вот почему:
1.Мастера оперативно сделают диагностику техники и выявят масштаб и место поломки. Это позволит не только устранить неисправность, но и предотвратить другие сбои.
2.В сервисном центре аккуратно демонтируют комплектующие , почистят аппарат и при необходимости установят новые фирменные детали. Это позволит ликвидировать последствия залития и загрязнения техники.
3.По завершении починки аппарата работники сервис-центра сделают финальную проверку и предоставят бесплатную консультацию по вопросам профилактики поломок.
Чтобы избежать повреждений АКБ, пользователю следует соблюдать осторожность: не допускать полной разрядки, не передерживать батарею в состоянии зарядки и не подвергать ее механическим воздействиям. Особенно опасна для аккумуляторов жидкость, так что ее нужно держать как можно дальше от лэптопа Асус.
Услуги и гарантия на починку
Чтобы сэкономить деньги и время, оставляйте заявку на ремонт ноутбуков ASUS онлайн. Заполнив бланк на официальном сайте, наши клиенты получают 15-процентную скидку на ремонт. Кроме того, курьеры компании выполняют бесплатную доставку ноутов по городу и в пределах 80 км за его чертой. Заказать услуги можно в любое время дня и ночи – call-центр круглосуточно обрабатывает заказы, а мастерские филиалов, открытых в России и ближнем зарубежье, восстанавливают технику без выходных. На замену и реанимацию деталей клиенты получают гарантию до трех лет.
Как работает аккумулятор — инженерное мышление
Батареи, мы используем их каждый день во всем мире, но как они работают? Это то, о чем мы расскажем в этой статье, спонсируемой Squarespace. Зайдите на squarespace.com, чтобы начать бесплатную пробную версию, или воспользуйтесь набором идей разработки кода, чтобы сэкономить 10% на сайтах и доменах.
БатареиПрокрутите вниз, чтобы посмотреть видео на YouTube.
Что такое батарея?
Батарея — это устройство, используемое для хранения энергии, когда она нам нужна.Мы используем их для питания небольших электрических устройств, таких как фонарики. Энергия сохраняется в виде химической энергии, и она может быть преобразована в электрическую, когда нам это нужно. Мы увидим, как это работает, чуть позже в статье.
Схема батареи и лампыЕсли мы посмотрим на простую схему батареи и лампы. Чтобы осветить лампу, нам нужно, чтобы через нее протекали электроны. Батарея будет обеспечивать толкающую силу, которая позволяет электронам проходить через лампу. Нам просто нужно подключить лампу к положительной и отрицательной клеммам батареи, чтобы замкнуть цепь.Батарея может толкать электроны только в течение определенного времени, это время зависит от того, сколько энергии хранится внутри батареи и сколько требуется нагрузке.
Примеры нагрузокКогда мы говорим о нагрузке в электрической цепи, мы имеем в виду любые компоненты, для работы которых требуется электричество, это могут быть резисторы, светодиоды, двигатели постоянного тока или даже целые печатные платы. Некоторые батареи можно перезаряжать, и это будет четко указано на стороне, но типичная бытовая щелочная батарея не может, поэтому ее просто утилизируют, когда в ней заканчивается энергия.Они могут быть переработаны, поэтому убедитесь, что вы утилизируете их ответственно.
Между прочим, если вы хотите узнать, как работает двигатель постоянного тока, мы уже подробно рассказали об этом ранее — посмотрите ЗДЕСЬ.
Что внутри батареи?
Типичная щелочная батарея на 1,5 В выглядит примерно так, но цвета зависят от производителя. Когда мы смотрим на батарею, у нас обычно есть пластиковая обертка, плотно прилегающая снаружи, она изолирует батарею, но также сообщает нам важную информацию, такую как емкость и напряжение, а также то, какой конец является положительным и отрицательным.
Щелочная батареяПоложительный конец, известный как катод, будет иметь эту расширенную поверхность, которая выступает наружу.
Положительный конецОтрицательный конец будет плоским, отрицательный конец известен как анод. Эти две клеммы электрически изолированы друг от друга.
Negative EndПод оберткой мы находим основной кожух, который обычно делается из стали с никелевым покрытием. Это удерживает все внутренние компоненты на месте и предотвращает их взаимодействие с элементами атмосферы, такими как воздух и вода.
Под WrapperВнутри корпуса у нас есть несколько слоев из разных материалов, эти материалы специально выбраны, потому что их химические реакции создают определенные уровни напряжения и тока. Первый слой — это катод, который представляет собой смесь оксида марганца (MnO2) и графита. Этот материал контактирует с металлом положительной клеммы. Графит добавлен для улучшения проводимости смеси и увеличения плотности энергии.
Первый слойЗатем мы находим слой пористого материала, обычно волокнистой бумаги, который образует барьер.Барьер предотвращает прямой контакт материалов анода и катода друг с другом, это помогает батарее работать дольше, когда она не используется. Если бы барьера не было, то произошло бы короткое замыкание аккумулятора. Микроскопические отверстия в материале позволяют ионным атомам проходить через него. Мы рассмотрим это более подробно позже в этой статье.
BarrierЗатем во время производственного процесса на сепаратор распыляется жидкий электролит, состоящий из гидроксида калия, который пропитывает его и впитывается анодным материалом.Используемый электролит является щелочным, поэтому мы называем этот тип батареи щелочной батареей.
Распыленный жидкий электролитС другой стороны барьера у нас есть анод, который представляет собой пасту из цинкового порошка (Zn), а также гелеобразующего агента. Желирующий агент просто удерживает цинк во взвешенном состоянии, чтобы он не скапливался в одном месте. Цинк находится в форме порошка для увеличения площади поверхности материала, что снижает внутреннее сопротивление и, таким образом, улучшает перенос электронов.
Внутри батареиСтальная капсула закрыта нейлоновой пластмассовой крышкой. Затем в цинк вставляется латунный штифт, поверх которого надевается стальной колпачок. Это дает нам отрицательную клемму. Обратите внимание, что положительная и отрицательная клеммы разделены пластиковой крышкой. Это гарантирует, что они электрически изолированы друг от друга, в противном случае электроны могут протекать через корпус, достигая положительной клеммы и замыкая аккумулятор.
Положительные и отрицательные, разделенныеОсновы электроэнергетики
Нам нужно понять некоторые основы того, как работает электричество, прежде чем мы сможем понять батарею.
Во-первых, электричество — это поток электронов в цепи. Батареи могут создавать толкающую силу, которая перемещает электроны по цепи. Электроны хотят вернуться к своему источнику, и они немедленно выберут любой путь, который возможен для этого. Помещая такие предметы, как лампы, на пути электронов, мы можем заставить их выполнять работу за нас, например, освещать лампу.
Основы электричестваБатареи вырабатывают постоянное электричество или постоянный ток. Это означает, что электроны текут только в одном направлении от отрицательного к положительному.Осциллограф покажет постоянный ток в виде плоской линии в положительной области. Вы можете думать об электричестве постоянного тока как о реке, которая течет только в одном направлении.
Постоянный токВ этих анимациях мы показываем поток электронов от отрицательного к положительному, но вы, возможно, привыкли видеть обычный ток от положительного к отрицательному. Электронный поток — это то, что происходит на самом деле, но обычный ток был исходной теорией, которая все еще широко используется и преподается по сей день. Просто помните о двух и о том, какой из них мы используем.
Переменный токЭлектроэнергия, которую вы получаете от розеток в ваших домах, обеспечивает электричество переменного или переменного тока, это отличается от электричества, вырабатываемого батареей. При переменном токе электроны непрерывно движутся вперед и назад, подобно морскому приливу, который течет между приливом и отливом. Осциллограф покажет переменный ток как волну, проходящую как через положительную, так и через отрицательную области, потому что он течет вперед, то есть положительно, и назад, то есть отрицательно.
Переменный токЕсли мы посмотрим на отрезок медной проволоки, внутри мы обнаружим атомы меди. В центре атома у нас есть протоны и нейтроны, протоны положительно заряжены, а нейтроны считаются нейтральными, поэтому у них нет заряда. Это электроны, вращающиеся по орбите, отрицательно заряженные.
Copper WireНекоторые из этих электронов могут свободно перемещаться к другим атомам. Они будут естественно перемещаться между другими атомами, но в случайных направлениях, что для нас бесполезно.Нам нужно, чтобы много электронов текло в одном направлении, и мы можем сделать это, обеспечив разность напряжений от источника питания, такого как батарея.
Когда мы говорим об атомах, вы часто слышите термин «ион». Ион — это просто атом, в котором неравное количество электронов или протонов. Атом имеет нейтральный заряд, когда у него одинаковое количество протонов и электронов, потому что протоны заряжены положительно, а электроны отрицательно заряжены, поэтому они уравновешиваются. Если в атоме электронов больше, чем протонов, то это отрицательный ион.Если в атоме протонов больше, чем электронов, это положительный ион.
IonНапряжение похоже на давление в резервуаре с водой. Чтобы узнать, какое у нас давление, мы должны сравнить давление внутри трубы с давлением снаружи, и для этого мы используем манометр. Что касается напряжения, мы используем вольтметр для измерения разницы в напряжении между двумя разными точками. Если мы измеряем разницу на батарее, мы получаем 1,5 В, но если мы измеряем тот же конец, мы получаем 0 В, потому что это тот же конец, поэтому разницы нет.
Напряжение как давлениеНекоторые материалы позволяют электронам легко проходить сквозь них, они известны как проводники. Примеры тому — медь и большинство металлов. Другие материалы не пропускают электроны, они известны как изоляторы. Резина и большинство пластмасс являются примерами этого. Поэтому мы используем медные провода с резиновой изоляцией. Медь транспортирует электричество туда, где оно нам нужно, а резина защищает нас.
Смешивая определенные материалы, мы можем вызвать химические реакции.Это когда атомы одного материала взаимодействуют с атомами другого материала, и во время этого взаимодействия атомы будут связываться или распадаться, электроны также могут захватываться или высвобождаться атомами во время химической реакции.
Хорошо, теперь, когда у нас есть основы, давайте заглянем внутрь батареи и посмотрим, как она работает.
Как работает щелочная батарея?
Помните, мы коротко говорили об атомах. Что ж, все эти материалы внутри батареи состоят из множества разных атомов, плотно упакованных вместе.Они представлены цветными шарами, каждый из которых представляет другой материал и, следовательно, другой атом, для нашего очень упрощенного примера. Когда мы объединим все эти материалы вместе внутри капсулы, мы получим небольшую химическую реакцию, в которой атомы начнут взаимодействовать друг с другом.
Внутри батареиПрежде всего, атом гидроксид-иона в электролите собирается соединиться с атомом цинка в анодной секции. Эта химическая реакция, известная как окисление, приводит к образованию гидроксида цинка, так как цинк и гидроксид объединяются и высвобождают электроны.Эти электроны теперь могут свободно перемещаться и собираются на латунном стержне.
В то же время атом оксида марганца соединяется с молекулой воды из электролита, а также со свободным электроном в химической реакции, известной как восстановление. Во время химической реакции оксид марганца превращается в немного другую версию оксида марганца, этой версии больше не нужен атом гидроксид-иона, поэтому он выбрасывает его в электролит. Атом воды заменяется атомом, выброшенным из реакции окисления.Ион гидроксида теперь свободен и может проходить через сепаратор. Но пока этого не произойдет, потому что в анодной секции для него нет места.
Скопление электроновИтак, как вы можете видеть, мы имеем скопление электронов на отрицательной клемме. Поскольку электроны заряжены отрицательно, и теперь у нас больше электронов на отрицательном выводе, чем на положительном, это означает, что у нас есть разница напряжений между двумя концами, и мы можем измерить эту разницу с помощью мультиметра.
Помните, что мы можем измерить только разницу в напряжении между двумя разными точками.Если мы измерим одну и ту же точку, мы получим ноль вольт, потому что нет никакой разницы.
Электроны отталкиваются друг от друга и хотят перейти в область с меньшим количеством электронов. В положительной области меньше электронов, поэтому они будут пытаться добраться до этой клеммы. Сепаратор предотвращает их протекание внутрь батареи к положительной клемме.
Следовательно, электронам нужен другой путь. Если мы предоставим электронам внешний путь, такой как провод, электроны будут проходить через него, чтобы добраться до положительного вывода.Поместив такие предметы, как лампа, на пути электронов, электроны должны будут пройти через это, и поэтому мы заставим их выполнять работу за нас, например, освещать лампу.
Зажигание лампыПока у нас есть замкнутая цепь между выводами, химическая реакция будет продолжаться, и электроны будут течь от отрицательной клеммы. Если мы удалим провод или разорвем цепь, химическая реакция прекратится.
Итак, давайте вспомним происходящую химическую реакцию.Свободные электроны попадают в аккумулятор через положительный полюс. Он соединяется с оксидом марганца и молекулой воды на катоде, которая выделяет ион гидроксида в электролит.
Ион гидроксида проходит через сепаратор и соединяется с атомом цинка, образуя гидроксид цинка, при этом высвобождаются электроны и молекула воды. Электроны хотят попасть в область с меньшим количеством электронов, положительный вывод имеет меньше электронов, поэтому они будут проходить через провод, чтобы достичь этого, и поэтому химическая реакция повторяется снова и снова непрерывно.
Однако внутри батареи есть только определенное количество материала, поэтому со временем химическая реакция будет становиться все труднее и труднее, и в конечном итоге электроны перестанут течь. Батарея больше не будет использоваться, и ее необходимо утилизировать.
Соединение батарей вместе
Мы можем использовать батарею для питания некоторых компонентов, но обычно одной батареи недостаточно для питания наших устройств, для этого нам нужно объединить батареи.
Батареи можно подключить двумя способами.Последовательный или параллельный. Мы подробно рассмотрели эти типы схем ранее, посмотрите серию ЗДЕСЬ и параллельную ЗДЕСЬ.
СерияКогда мы соединяем батареи последовательно, напряжения каждой батареи складываются. Таким образом, две батареи на 1,5 В дают нам 3 В, а 3 батареи дают нам 4,5 В и т. Д. Фактическое напряжение может немного отличаться в реальном мире. Напряжение увеличивается, потому что каждая батарея увеличивает количество электронов, попадающих в нее, поэтому мы получаем более высокое напряжение.
ПараллельныйЕсли мы подключим батареи параллельно, то мы получим только 1,5 В независимо от того, сколько мы подключим. Это потому, что путь сливается в источнике питания, но разделяется на обратном, поэтому электроны не будут ускоряться. Однако этот тип конфигурации сможет обеспечить больший ток, а также будет иметь большую емкость, поэтому мы сможем питать что-то дольше. Например, если аккумулятор имеет емкость 1200 мАч, и мы поместили два параллельно, у нас будет емкость 2400 мАч, но при напряжении 1.5В. Если мы подключим их последовательно, у нас будет емкость 1200 мАч, но напряжение 3 В.
Последовательный и параллельныйЕмкость
Мы используем батареи для питания наших цепей. Но как долго батарея может питать нашу схему? Когда мы смотрим на упаковку или технический паспорт аккумулятора, мы видим рядом с ним значение с буквами m.A.h. Это номинальное значение в миллиампер-часах.
Пример батареиНапример, у этого есть номинал 2500 мАч. Это означает, что теоретически он может обеспечить ток 2500 мА в час, 1250 мА в течение 2 часов или 20 мА в течение 125 часов.Однако в реальной жизни это, вероятно, не продержится так долго, потому что химическая реакция замедляется, поэтому внутреннее сопротивление батареи изменяется по мере ее разряда. На это влияет множество других факторов, например, возраст и температура.
Нет реального способа точно рассчитать продолжительность жизни, лучший способ — просто проверить ее. Однако мы можем оценить продолжительность жизни по следующей формуле:
Срок службы батареи = Емкость (мАч) / ток цепи (мА).
Мы создали бесплатный простой калькулятор на нашем веб-сайте, где вы можете оценить время работы аккумулятора, а также необходимую емкость. Убедитесь, что ЗДЕСЬ .
Так, например, в этой схеме мы вычисляем потребность в 19 мА, а аккумулятор имеет емкость 3000 мАч. Таким образом, 3000/19 дает нам 157,9 часа. Это действительно лучший сценарий, и на самом деле он почти наверняка не приведет к этому.
Срок службы батареиКак измерить мультиметром
Чтобы измерить напряжение, мы просто выбираем функцию постоянного тока на нашем мультиметре, а затем подключаем красный провод к положительной клемме, а черный провод — к отрицательной.Это даст нам значение напряжения.
Рейтинг батареиВы можете видеть, что эта батарея рассчитана на 1,5 В, но когда мы ее протестируем, мы получим 1,593 В
Battery DeadКогда батарея разряжена, мы получаем более низкое напряжение, это 1.07V, поэтому она полностью разряжена.
Однако иногда мы все равно можем получить напряжение около 1,5 В, даже если батарея разряжена.
Чтобы полностью протестировать аккумулятор, нам нужно протестировать его под нагрузкой, чтобы убедиться, что он по-прежнему полезен. Для этого нам понадобится резистор.
Тестовая батареяИтак, мы берем резистор около 100 Ом, хотя он не обязательно должен быть точно таким же, но мы подключаем резистор между двумя нашими пробниками. В данном случае мы использовали зажимы типа «крокодил» для подключения резистора между датчиками, вот так.
Таким образом, ток будет течь через резистор, и мы сможем измерить напряжение, когда это произойдет. Если аккумулятор все еще в порядке, то уровень напряжения упадет незначительно.
Пример батареиНапример, эта батарея имеет номинальное напряжение 1.5 В, без нагрузки — 1,593 В, с подключенным резистором — 1,547 В, так что это все еще хорошо.
Пример батареиЭта батарея также рассчитана на 1,5 В, когда мы измеряем ее без нагрузки, она показывает точно 1,5 В, но когда мы подключаем резистор, он падает до 0,863 В, поэтому мы знаем, что он разрядился.
Battery DeadНо теперь, когда вы все заряжены, проверьте squarespace.com , чтобы создать свое собственное присутствие в Интернете, в котором есть множество функций, позволяющих людям запускать, публиковать и продвигать свои собственные проекты.
Существуют мощные инструменты для ведения блога, позволяющие демонстрировать фотографии, видео и новости о ваших проектах.
Вы можете легко запланировать встречи на занятиях и занятия с членами команды и клиентами с помощью встроенного инструмента. И вы даже можете собирать платежи или пожертвования, чтобы поддержать свое дело.
Зайдите на squarespace.com, чтобы получить бесплатную пробную версию, а когда вы будете готовы к запуску, перейдите на squarespace.com/engineeringmindset , чтобы сэкономить 10% на первой покупке веб-сайта или домена.
О Аккумуляторы
Гэри Л. Бертран
Профессор химии
Университет Миссури-Ролла
Моделирование Вернуться к началу
Батарея состоит из одного или нескольких электрохимических элементов. Каждая ячейка содержит два металлических электрода и как минимум один раствор электролита. (раствор, содержащий ионы, которые могут проводить электричество).Батарея действует посредством электрохимических реакций, называемых окислением и восстановлением. Эти реакции включают обмен электронами между химическими частицами. Если химическое вещество теряет один или несколько электронов, это называется окислением. Противоположный процесс — усиление электронов — называется редукцией.
Окисление происходит на аноде.
Восстановление происходит на катоде.
Если реактивные компоненты электрохимические ячейки контактируют друг с другом, они будут реагируют прямым переносом электронов ( окисление — реакция восстановления) и там невозможно использовать эту энергию для выполнения электрических работ.Большинство из энергия реакции выделяется в виде тепла. Выделяемое тепло тесно связан со стандартным изменением энтальпии (дельта-Н °) реакции.
В большинстве аккумуляторов используются разные материалы. два электрода, так что они хотят реагировать с одним материалом, окисляется, а другой восстанавливается. В ячейке ниже цинк используется для электрода слева (анод), контактирующего с раствором ионов цинка (II), возможно, раствор Цинк Нитрат.Медь используется для электрод справа (Катод) в контакте с раствором, содержащим Медь (II) ионы, возможно Нитрат меди. Разделяя материалы, электроны, производимые окисление на аноде может быть использовано для выполнения электрических работ в том виде, в котором они переносятся на катод, где они будут потребляться восстановлением процесс. Количество электромонтажных работ, которые может произвести аккумулятор. тесно связано со стандартным изменением свободной энергии (дельта-G °) реакции.
Однако процесс окисления дает положительный ионов или удаляет отрицательные ионы из раствора на аноде (или это может заменить один ион на более положительный), и процесс восстановления либо удаляет положительные ионы или производит отрицательные ионы в растворе на катод. В результате получаются электрически заряженные растворы, и очень быстро останавливает процесс до того, как будет перенесено измеримое количество электронов.
Должен быть путь для перемещения ионов между два решения, чтобы электроны могли непрерывно течь через провод. Это создает «ионный ток» внутри аккумулятор с катионами (положительно — заряженный ионы) движутся от анода к катоду, а анионы (отрицательно заряженные ионы) движутся от катода к аноду.
Этот путь может быть обеспечен двумя решениями контактируют друг с другом, но это позволяет диффузию всех ионов и довольно быстро «разряжает» аккумулятор.Это распространение может быть замедляется за счет разделения растворов мембраной или пористой пробкой. Все это может привести к «потенциалу жидкого перехода». из-за разной скорости движения катионов и анионов. Соль мост »может использоваться для разделения двух растворов с помощью третьего концентрированного раствор хорошо подобранных катионов и анионов, полностью устраняя «потенциал жидкого перехода». В нескольких корпусов, можно сконструировать батарею так, чтобы оба электрода могли быть помещен в тот же контейнер только с одним раствором.
*********************************************** *
Напряжение ячейки может зависеть от многих факторов: материалы электродов, компоненты и концентрации растворов, тип жидкостного перехода, температура и давление. В Напряжение также зависит от электрического тока, протекающего из ячейки. Напряжение (E) и ток (I) связаны с сопротивлением (R) через Закон Ома: E = IR Ток напрямую связан к скорости, с которой электроны прокачиваются через провод и любые сопротивления в цепи.Когда сопротивление понижается до нуля (короткое замыкание), ток увеличивается, а напряжение ячейки уменьшается до нуля. В виде сопротивление увеличивается, ток уменьшается, а напряжение увеличивается к предельному значению. В химии, нас в первую очередь интересует это предельное значение, максимальное напряжение что может доставить электрохимический элемент. Этот максимум напряжение или электрохимический потенциал — это мера максимума электромонтажные работы, которые можно получить от химическая реакция, происходящая внутри клетки, и это может быть связано к свободной энергии Гиббса Изменения, связанные с химической реакцией.Прежде чем мы закончим обсуждение, обсудим термодинамику. аккумуляторов, нам необходимо устранить влияние концентрации на напряжение ячейки. Это может быть несколько сложным и запутанным. Мы собираемся избежать этих проблем, сосредоточив внимание на ячейках с очень специфическим тип химической реакции.
*********************************************** *
В ячейке выше электроны производятся свинцом. металл окисляется до ионов свинца (II), а ионы меди (II) восстанавливаются к металлической меди.Даже если ионы движутся через границу между в растворах наблюдается увеличение концентрации ионов свинца на слева и уменьшение ионов меди справа. Это вызывает напряжение батареи уменьшится, и в конечном итоге напряжение будет уменьшаются до нуля. Некоторые батареи рассчитаны на перезарядку. заставляя электроны течь назад через ячейку, обращая химическая реакция.Уравнение Нернста описывает влияние концентраций на максимальное напряжение, которое реакция может быть произведена путем соотнесения напряжения со стандартом Электрохимический потенциал (E °).Этот стандарт Электрохимический потенциал представляет собой максимальное напряжение реакции может производить со всеми стандартными компонентами состояниях или при единичной деятельности.
*********************************************** *
Остальная часть этого обсуждения будет касаться с электрохимическими ячейками, не предполагающими изменения концентраций ионов или газов. В этих ячейках Стандарт Электрохимический потенциал можно измерить напрямую.Один из способов сделать это — использовать металл / металл. Солевые электроды, которые получают путем покрытия металла одним его нерастворимых солей (или оксида), как в Silver / Silver Хлорид, свинец / сульфат свинца или ртуть / ртуть Хлоридные (каломелевые) электроды. Эти обычно являются твердым металлом и твердой солью, хотя в случае ртути металл — чистая жидкость. Электрический контакт обычно осуществляется через платиновый провод, контактирующий с ртуть.
Эта ячейка сконструирована с отведением / отведением Сульфатный анод и серебро / сульфат серебра катод, оба в растворе сульфата натрия. Два раствора разделены анионным обменом. мембрана, позволяющая проходить через нее отрицательно заряженным ионам, но положительно заряженные ионы не могут. Напряжение этой ячейки все еще зависит от тока, протекающего от него, и от температуры. Однако при любой фиксированной температуре максимальное напряжение (при очень малом токе) не зависит от концентрации электролита и равна Стандартный электрохимический потенциал для это реакция.
верх
Внутри аккумуляторов, питающих ваш автомобиль, телефон и многое другое
Батареи завоевали современный мир, не сильно изменившись.
Смартфон, для сравнения, имеет гораздо меньше общего с предшествующими ему мэйнфреймами. То же самое касается Tesla Model 3 и Ford Model T. Но литий-ионная технология, используемая в современных батареях, выдержала десятилетия экспоненциального роста — переход от гаджетов к электромобилям и даже порождение нескольких миллиардеров на этом пути — без серьезных изменений в его структура с тех пор, как Sony впервые коммерциализировала технологию в 1991 году.
Это не потому, что химики не пробовали. Просто разработка новых материалов, отвечающих промышленным стандартам, — очень сложная проблема.
Все батареи состоят из четырех компонентов: двух электродов (анода и катода), жидкого электролита, который помогает ионам перемещаться между электродами, и разделителя, предотвращающего прямой контакт электродов друг с другом и предотвращающего возгорание. Когда батарея заряжена, ионы текут от катода к аноду. Когда он разряжается, ионы меняют свой курс.
По мере того, как мир движется к быстрому сокращению выбросов парниковых газов, продолжается гонка за то, чтобы подключить к еще более мощным батареям больше вещей: электросети, грузовики, корабли и даже самолеты. Внутреннее пространство этой важной технологии, наконец, готово увидеть драматические изменения, и ряд скрытых стартапов обещает прорывы. QuantumScape Corp. утверждает, что создала новый материал для аккумуляторов, который позволит электромобилям путешествовать дальше и заряжаться намного быстрее, и в результате стартап имеет оценку, которая в последние недели колеблется от 13 до 20 миллиардов долларов, даже без каких-либо доходов от продаж. зрение.Его конкуренты, в том числе такие гиганты, как Samsung и Panasonic, также гонятся за батареями следующего поколения.
Прежде чем мы перейдем к аккумуляторному будущему, важно понять физическую эволюцию современной литий-ионной технологии. Миллиарды людей используют телефоны с более быстрой подзарядкой и автомобили с большей дальностью действия, но немногие из нас могут объяснить, что стоит за этими улучшениями. Это история хитростей: небольшая эффективность производства, небольшие улучшения в материалах и небольшой прирост производительности.
Батарея оценивается по тому, сколько энергии она заряжает. Этот ключевой фактор тесно связан со скоростью зарядки аккумулятора, количеством циклов заряда-разряда, которое он может выдержать, и безопасностью. Повышенная плотность энергии также может сделать его более подверженным возгоранию. Более высокая скорость перезарядки может привести к сокращению жизненных циклов.
В конечном счете, цена царит безраздельно. Это определяется тем, сколько энергии может хранить батарея, материалами, из которых она изготовлена, и толщиной электродного покрытия, которое можно нанести без ущерба для характеристик.Чем ниже стоимость, тем дешевле электромобиль.
За последнее десятилетие небольшие разработки привели к совокупному снижению стоимости литий-ионных батарей более чем на 90%. Группа BloombergNEF, занимающаяся исследованиями в области экологически чистой энергии, ожидает, что с учетом будущих разработок в ближайшее десятилетие затраты снизятся вдвое. Электромобили уже сейчас конкурентоспособны во многих странах, если учесть затраты на топливо в течение срока службы автомобиля, но по мере дальнейшего снижения стоимости аккумуляторов даже ориентировочная цена электромобилей будет дешевле, чем цена на бензиновые альтернативы.
Возвращаясь к началу, литий-ионный аккумулятор был получен в исследовательской лаборатории Exxon еще в 1970-х годах. Металлический литий, из которого сделан анод батареи, продолжал вызывать пожары, что привело к тому, что Exxon отказалась от этой идеи. Академический интерес продолжался, и ученые из разных частей мира разрабатывали более безопасные материалы.
Американский ученый Джон Гуденаф обнаружил, что катоды, полностью сделанные из кобальта, более безопасны и хранят больше энергии. Это открытие принесло ему Нобелевскую премию по химии в 2019 году.Затем марокканский ученый Рашид Язами обнаружил, что использование графита, формы углерода, в качестве анода, сделало литий-ионную батарею намного более стабильной и, таким образом, помогло ей прослужить дольше. Наконец, Кейдзабуро Тозава, глава аккумуляторного подразделения Sony в 1990-х годах, объединил все эти изобретения, чтобы создать первую коммерческую литий-ионную батарею.
Несмотря на то, что кобальт — дорогой металл, он оставался доступным для использования в небольших батареях ранних ноутбуков и мобильных телефонов. Но как только литий-ионные батареи начали использоваться в электромобилях, химики стали искать более дешевые металлы, такие как никель, марганец и даже железо.
Альтернативные металлы требуют тщательной оценки. Если дешевый металл означает непропорционально худшую производительность батареи, этого не пойдет. Благодаря миллионам экспериментов на рынке стали доминировать три типа катодов: оксиды никель-марганца-кобальта (NMC), оксиды никель-кобальта-алюминия (NCA) и фосфат лития-железа (LFP).
Давайте заглянем внутрь черного ящика, который представляет собой батарею, чтобы понять, как мы сюда попали и что будет дальше.
Сокращение содержания кобальта с помощью NMC
Одной из первых альтернатив кобальту было использование никеля и марганца, которые превышали способность кобальта накапливать ионы лития.Но полностью потерять кобальт было невозможно. Химики узнали, что кобальт играет роль учителя в школе, дисциплинируя непослушные ионы лития во время их движения и гарантируя, что батарея продержится большее количество циклов заряда-разряда.
За несколько лет исследований химикам удалось увеличить толщину материала анода и катода, которые являются энергоносителями в батарее, по сравнению с другими деталями. Методом проб и ошибок они также нашли смесь, в которой можно было бы использовать меньше кобальта и больше никеля.Все это помогает накапливать больше ионов лития на единицу объема и массы, что помогает увеличить удельную энергию батареи. Это, в свою очередь, увеличивает запас хода автомобиля и снижает его ориентировочную цену.
Алюминий прибывает с Tesla NCA
Вместо марганца Tesla и ее партнер по производству аккумуляторов, Panasonic, обнаружили, что алюминий также может выполнять эту работу. В то время это считалось более рискованным делом, чем химия NMC, но ставка окупилась для Tesla. NCA также был дешевле, чем NMC, потому что это еще больше снизило использование кобальта.Химия стала основой автомобилей Tesla, которые часто могут похвастаться превосходными характеристиками по сравнению с другими электромобилями.
ХимикиTesla также обнаружили, что добавление небольшого количества оксида кремния, например, перца в макароны, помогает уменьшить количество графита, необходимое для хранения того же количества ионов лития. Это помогло уменьшить вес батареи без ущерба для производительности и снизить ее стоимость. Модель 3 была выпущена с этим новым химическим составом и помогла Tesla создать самый доступный автомобиль на сегодняшний день.
Нет необходимости в кобальте с LFP
Конечная цель катодных материалов нынешнего поколения — полностью отказаться от использования кобальта. Первой попыткой этого было развитие химии LFP, которая сделала использование железа доступным по очень низким ценам. Батарея хорошо себя показала по большинству показателей, но она не могла удерживать столько ионов лития, сколько могли бы иметь катоды с высоким содержанием кобальта.
Однако экономическая выгода была достаточно большой, чтобы батареи LFP нашли применение в дешевых электромобилях, таких как такси, и в электрических автобусах, которым требовались аккумуляторные блоки гораздо большего размера.Поскольку автобусы нуждаются в гораздо более крупных аккумуляторных батареях, а такси должно быть как можно более дешевым, это помогло сделать самый дешевый литий-ионный аккумулятор лучшим кандидатом для другого сегмента рынка электромобилей.
Более десяти лет работы помогли LFP-батареям улучшить производительность, даже несмотря на то, что они по-прежнему уступают химическим составам катодов на основе кобальта по плотности энергии. Основным преимуществом стало создание стабильной батареи с более толстыми материалами электродов. В сложной химической смеси, которая представляет собой батарею, небольшое увеличение толщины — немалый подвиг.
В будущее твердого тела
Конечная цель анода в литий-ионной батарее — использовать металлический литий. Стремление создать этот материал привело к плачевным результатам. Металлический литий нестабилен и склонен к возгоранию. Внутри аккумулятора при зарядке и разрядке он также имеет тенденцию образовывать тонкие нити, называемые дендритами, которые могут прорезать сепаратор и контактировать с катодом. Это вызывает короткое замыкание, а затем пожар. Пожары аккумуляторных батарей потушить гораздо труднее, чем возгорания двигателей внутреннего сгорания.
Химики-разработчики аккумуляторов десятилетиями пытались решить проблему дендритов. Одной из многообещающих попыток является использование твердого электролита для замены жидкости в системе и подавления образования дендритов. Эта технология получила новое название: твердотельный аккумулятор. Если твердотельные аккумуляторы появятся на рынке во второй половине этого десятилетия, как и ожидалось, они, вероятно, будут представлять собой большой скачок в производительности аккумуляторов, увеличивая диапазон электромобилей на 50% и сокращая время зарядки до 15. минут.
Поскольку металлический литий выглядит многообещающим анодным материалом, химики-химики снова ищут новые катодные материалы. Ожидается, что эти новые материалы, не содержащие кобальта, еще больше повысят плотность энергии, что может сделать батареи достаточно легкими для питания электрических самолетов. Литий-ионные аккумуляторы прошли долгий путь от лабораторий Exxon до переворота в автомобильной промышленности. И тем не менее, для мира это только начало использования потенциала этой экологически чистой технологии.
Исправление: в статье ранее говорилось, что Гуденаф был британцем. Он американец, но получил Нобелевскую премию в Оксфордском университете в Великобритании.
Что такое батарея? — learn.sparkfun.com
Добавлено в избранное Любимый 22Введение
Батареи представляют собой совокупность одной или нескольких ячеек, химические реакции которых создают поток электронов в цепи.Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и какого-то электролита (вещество, которое химически реагирует с анодом и катодом).
Когда анод и катод батареи подключены к цепи, между анодом и электролитом происходит химическая реакция. Эта реакция заставляет электроны проходить через цепь и возвращаться к катоду, где происходит другая химическая реакция.Когда материал катода или анода расходуется или больше не может быть использован в реакции, батарея не может производить электричество. В этот момент ваша батарея «разряжена».
Батареи, которые необходимо выбросить после использования, известны как первичные батареи . Батареи, которые можно перезаряжать, называются вторичными батареями .
Литий-полимерные батареи, например, заряжаемые
Без батарей ваш квадрокоптер пришлось бы привязать к стене, вам пришлось бы вручную провернуть машину, а ваш контроллер Xbox должен был бы быть постоянно подключен к розетке (как в старые добрые времена).Батареи позволяют хранить потенциальную электрическую энергию в переносном контейнере.
Батареи бывают разных форм, размеров и химического состава.
Изобретение современной батареи часто приписывают Алессандро Вольта. На самом деле все началось с удивительной аварии, связанной с рассечением лягушки.
Что вы узнаете
В этом руководстве будут подробно рассмотрены следующие темы:
- Как были изобретены батарейки
- Из каких частей состоит аккумулятор
- Как работает аккумулятор
- Общие термины, используемые для описания батарей
- Различные способы использования батарей в схемах
Рекомендуемая литература
Есть несколько концепций, с которыми вы, возможно, захотите ознакомиться перед тем, как начать читать это руководство:
Хотите изучить различные батареи?
Мы вас прикрыли!
Щелочная батарея 9 В
В наличии PRT-10218Это ваши стандартные щелочные батарейки на 9 вольт от Rayovac.Даже не думайте пытаться перезарядить их. Используйте их с…
1История
Термин Батарея
Исторически слово «батарея» использовалось для описания «серии подобных объектов, сгруппированных вместе для выполнения определенной функции», как в артиллерийской батарее. В 1749 году Бенджамин Франклин впервые использовал этот термин для описания серии конденсаторов, которые он соединил вместе для своих экспериментов с электричеством.Позже этот термин будет использоваться для любых электрохимических ячеек, связанных вместе с целью обеспечения электроэнергии.
Батарея «конденсаторов» Лейденской банки соединена вместе(Изображение любезно предоставлено Альвинруном из Wikimedia Commons)
Изобретение батареи
В один роковой день 1780 года итальянский физик, врач, биолог и философ Луиджи Гальвани рассекал лягушку, прикрепленную к медному крючку. Когда он коснулся лягушачьей лапы железным отростком, нога дернулась.Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Вольта выдвинул гипотезу, что импульсы лягушачьей лапки на самом деле вызываются разными металлами, пропитанными жидкостью. Он повторил эксперимент, используя ткань, пропитанную рассолом, вместо трупа лягушки, что привело к аналогичному напряжению. Вольта опубликовал свои открытия в 1791 году, а позже создал первую батарею, гальваническую батарею, в 1800 году.
Гальваническая свая состояла из пакета цинковых и медных пластин, разделенных тканью, пропитанной рассолом
СтопкаVolta страдала от двух основных проблем: из-за ее веса электролит вытек из ткани, а особые химические свойства компонентов привели к очень короткому сроку службы (около часа).Следующие двести лет уйдут на совершенствование конструкции Вольты и решение этих проблем.
Исправления в гальванической куче
Уильям Круикшанк из Шотландии решил проблему утечки, положив гальваническую батарею на бок, чтобы сформировать «желобную батарею».
Желобковая батарея решила проблему утечки гальванической сваи
Вторая проблема, короткий срок службы, была вызвана разложением цинка из-за примесей и скоплением пузырьков водорода на меди.В 1835 году Уильям Стерджен обнаружил, что обработка цинка ртутью предотвратит разложение.
Британский химик Джон Фредерик Дэниелл использовал второй электролит, который вступал в реакцию с водородом, предотвращая накопление на медном катоде. Батарея Даниэля с двумя электролитами, известная как «ячейка Даниэля», станет очень популярным решением для обеспечения энергией зарождающихся телеграфных сетей.
Коллекция клеток Даниэля из 1836 г.
Первая аккумуляторная батарея
В 1859 году французский физик Гастон Планте создал батарею из двух прокатанных листов свинца, погруженных в серную кислоту.Путем реверсирования электрического тока через батарею химия вернется в исходное состояние, создав первую перезаряжаемую батарею.
Позже, в 1881 году, Камилла Альфонс Фор улучшила конструкцию Планте, превратив листы свинца в пластины. Эта новая конструкция упростила производство аккумуляторов, и свинцово-кислотные аккумуляторы получили широкое распространение в автомобилях.
-> Дизайн обычного «автомобильного аккумулятора» существует уже более 100 лет
(Изображение любезно предоставлено Эмилианом Робертом Виколом из Wikimedia Commons) <-
Сухая камера
Вплоть до конца 1800-х годов электролит в батареях был в жидком состоянии.Это сделало транспортировку аккумуляторов очень осторожным делом, и большинство аккумуляторов никогда не предназначались для перемещения после подключения к цепи.
В 1866 году Жорж Лекланше создал батарею с цинковым анодом, катодом из диоксида марганца и раствором хлорида аммония в качестве электролита. Хотя электролит в элементе Лекланше был все еще жидким, химический состав батареи оказался важным шагом для изобретения сухого элемента.
Карл Гасснер придумал, как создать электролитную пасту из хлорида аммония и гипса.Он запатентовал новую батарею с «сухими элементами» в 1886 году в Германии.
Эти новые сухие элементы, обычно называемые «угольно-цинковыми батареями», производились массово и пользовались огромной популярностью до конца 1950-х годов. Хотя углерод не используется в химической реакции, он играет важную роль в качестве электрического проводника в углеродно-цинковой батарее.
-> Угольно-цинковая батарея 3 В 1960-х годов
(Изображение любезно предоставлено PhFabre из Wikimedia Commons) <-
В 1950-х годах Льюис Урри, Пол Марсал и Карл Кордеш из компании Union Carbide (позже известной как «Eveready», а затем «Energizer») заменили электролит хлористого аммония щелочным веществом на основе химического состава батареи, сформулированного Вальдемаром. Юнгнер в 1899 году.Щелочные батареи с сухими элементами могут содержать больше энергии, чем угольно-цинковые батареи того же размера, и имеют более длительный срок хранения.
Щелочные батареи приобрели популярность в 1960-х годах, обогнали угольно-цинковые батареи и с тех пор стали стандартными первичными элементами для потребительского использования.
-> Щелочные батареи бывают разных форм и размеров
(Изображение любезно предоставлено Aney ~ commonswiki из Wikimedia Commons) <-
Аккумуляторы 20-го века
В 1970-х годах компания COMSAT разработала никель-водородную батарею для использования в спутниках связи.Эти батареи хранят водород в газообразной форме под давлением. Многие искусственные спутники, такие как Международная космическая станция, по-прежнему используют никель-водородные батареи.
Исследования нескольких компаний с конца 1960-х годов привели к созданию никель-металлгидридной (NiMH) батареи. NiMH батареи были выпущены на потребительский рынок в 1989 году и стали более дешевой альтернативой никель-водородным аккумуляторным элементам меньшего размера.
Компания Asahi Chemical из Японии построила первую литий-ионную батарею в 1985 году, а Sony создала первую коммерческую литий-ионную батарею в 1991 году.В конце 1990-х годов был создан мягкий гибкий корпус для литий-ионных аккумуляторов, в результате чего появилась «литий-полимерная» или «LiPo» батарея.
Химические реакции в литий-полимерной батарее практически такие же, как и в литий-ионной батарее
Очевидно, что было изобретено, произведено и устарело гораздо больше химикатов батарей. Если вы хотите узнать больше о современных и популярных технологиях аккумуляторов, ознакомьтесь с нашим руководством по технологиям аккумуляторов.
Компоненты
Батареисостоят из трех основных компонентов: анода , катода и электролита . Сепаратор часто используется для предотвращения соприкосновения анода и катода, если электролита недостаточно. Для хранения этих компонентов аккумуляторы обычно имеют какой-то кожух .
Хорошо, большинство батарей на самом деле не разделены на три равные части, но идею вы поняли.Лучшее поперечное сечение щелочной ячейки можно найти в Википедии.И анод, и катод относятся к типу электродов . Электроды — это проводники, через которые электричество входит или выходит из компонента в цепи.
Анод
Электроны выходят из анода в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет в анод .
На аккумуляторах анод обозначен как отрицательная (-) клемма
В батарее химическая реакция между анодом и электролитом вызывает накопление электронов на аноде.Эти электроны хотят перейти к катоду, но не могут пройти через электролит или сепаратор.
Катод
Электроны текут в катод в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет из катода.
На батареях катод помечен как положительный (+) вывод
В батареях в химической реакции внутри катода или вокруг него используются электроны, образующиеся на аноде.Электроны могут попасть на катод только через цепь, внешнюю по отношению к батарее.
Электролит
Электролит — это вещество, часто жидкость или гель, которое способно переносить ионы между химическими реакциями, происходящими на аноде и катоде. Электролит также препятствует потоку электронов между анодом и катодом, так что электроны легче проходят через внешнюю цепь, чем через электролит.
-> В щелочных батареях может протекать электролит, гидроксид калия, если они подвергаются воздействию высоких температур или обратного напряжения
(Изображение любезно предоставлено Вильямом Дэвисом из Wikimedia Commons) <-
Электролит имеет решающее значение в работе аккумулятора.Поскольку электроны не могут проходить через него, они вынуждены проходить через электрические проводники в виде цепи, соединяющей анод с катодом.
Сепаратор
Сепараторы представляют собой пористые материалы, которые предотвращают соприкосновение анода и катода, что может вызвать короткое замыкание в батарее. Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы не вступают в химическую реакцию ни с анодом, ни с катодом, ни с электролитом.
В гальванической куче использовалась ткань или картон (разделитель), пропитанные рассолом (электролитом), чтобы электроды разнесены
Ионы в электролите могут быть положительно заряженными, отрицательно заряженными и иметь различные размеры. Могут быть изготовлены специальные сепараторы, которые пропускают одни ионы, но не пропускают другие.
Кожух
Большинству батарей требуется способ удерживать химические компоненты. Кожухи, также известные как «кожухи» или «оболочки», представляют собой просто механические конструкции, предназначенные для удержания внутренних компонентов батареи.
Свинцово-кислотный аккумулятор в пластиковом корпусе
Корпуса батареймогут быть изготовлены практически из чего угодно: из пластика, стали, пакетов из мягкого полимерного ламината и так далее. В некоторых батареях используется токопроводящий стальной кожух, который электрически соединен с одним из электродов. В случае обычного щелочного элемента AA стальной корпус соединен с катодом.
Операция
Батареи обычно требуют нескольких химических реакций для работы.По крайней мере, одна реакция происходит внутри или вокруг анода, и одна или несколько реакций происходят внутри или вокруг катода. Во всех случаях реакция на аноде производит дополнительные электроны в процессе, называемом окисление , а реакция на катоде использует дополнительные электроны в процессе, известном как восстановление .
Когда переключатель замкнут, цепь замыкается, и электроны могут течь от анода к катоду. Эти электроны активируют химические реакции на аноде и катоде.
По сути, мы разделяем определенный вид химической реакции, реакцию окисления-восстановления или окислительно-восстановительную реакцию, на две отдельные части. При переносе электронов между химическими веществами происходят окислительно-восстановительные реакции. Мы можем использовать движение электронов в этой реакции, чтобы они выходили за пределы батареи и питали нашу цепь.
Анодное окисление
Эта первая часть окислительно-восстановительной реакции, окисление, происходит между анодом и электролитом и производит электроны (обозначены как e — ).
В некоторых реакциях окисления образуются ионы, например, в литий-ионной батарее. В других химических реакциях расходуются ионы, как в обычных щелочных батареях. В любом случае ионы могут свободно проходить через электролит, а электроны — нет.
Катодное восстановление
Другая половина окислительно-восстановительной реакции, восстановление, происходит в катоде или рядом с ним. Электроны, образующиеся в результате реакции окисления, расходуются во время восстановления.
В некоторых случаях, например, в литий-ионных батареях, положительно заряженные ионы лития, образующиеся во время реакции окисления, расходуются во время восстановления.В других случаях, например, в щелочных батареях, во время восстановления образуются отрицательно заряженные ионы.
Электронный поток
В большинстве батарей некоторые или все химические реакции могут происходить, даже если батарея не подключена к цепи. Эти реакции могут повлиять на срок годности батареи.
По большей части, реакции будут происходить с полной силой только тогда, когда между анодом и катодом замыкается электрически проводящая цепь. Чем меньше сопротивление между анодом и катодом, тем больше электронов может течь и тем быстрее протекают химические реакции.
Короткое замыкание в аккумуляторе (в данном случае даже случайное) может быть опасным. Известно, что литий-ионные батареи перегреваются и даже задыхаются или загораются при коротком замыкании.
Мы можем пропускать эти движущиеся электроны через различные электрические компоненты, известные как «нагрузка», для выполнения чего-то полезного. В анимационном ролике в начале этого раздела мы зажигаем виртуальную лампочку движущимися электронами.
Батарея разряжена
Химические вещества в батарее в конечном итоге достигают состояния равновесия. В этом состоянии химические вещества больше не будут реагировать, и в результате аккумулятор больше не будет генерировать электрический ток. На данный момент аккумулятор считается «мертвым».
Первичные элементы необходимо утилизировать, когда батарея разряжена. Вторичные элементы можно перезаряжать, и это достигается путем пропускания через батарею обратного электрического тока.Перезарядка происходит, когда химические вещества выполняют еще одну серию реакций, чтобы вернуть их в исходное состояние.
Терминология
Люди часто используют общий набор терминов, говоря о напряжении батареи, емкости, возможности источника тока и так далее.
Ячейка
Элемент относится к одному аноду и катоду, разделенным электролитом, используемым для выработки напряжения и тока. Батарея может состоять из одной или нескольких ячеек.Например, одна батарея AA — это одна ячейка. Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В.
Обычная 9-вольтовая батарея содержит шесть щелочных элементов по 1,5 В, установленных друг над другом
Первичная
Первичные клетки содержат химический состав, который нельзя обратить вспять. В результате аккумулятор необходимо выбрасывать после того, как он разрядился.
Среднее
Вторичные элементы можно перезаряжать, и их химический состав возвращается в исходное состояние.Эти элементы, также известные как «перезаряжаемые батареи», можно использовать много раз.
Номинальное напряжение
Номинальное напряжение аккумулятора — это напряжение, указанное производителем.
Например, щелочные батареи типа AA указаны как имеющие напряжение 1,5 В. В этой статье Mad Scientist Hut показано, что их испытанные щелочные батареи начинаются с напряжения около 1,55 В, а затем медленно теряют напряжение по мере разряда. В этом примере номинальное напряжение «1,5 В» относится к максимальному или пусковому напряжению батареи.
Этот аккумуляторный блок Storm для квадрокоптеров показывает кривую разряда для их LiPo-элементов, начиная с 4,2 В и снижаясь до 2,8 В по мере разряда. Номинальное напряжение, указанное для большинства литий-ионных и LiPo-элементов, составляет 3,7 В. В этом случае номинальное напряжение «3,7 В» относится к среднему напряжению аккумулятора в течение его цикла разряда.
Вместимость
Емкость аккумулятора — это величина электрического заряда, который он может доставить при определенном напряжении. Большинство аккумуляторов рассчитаны на ампер-часы (Ач) или миллиампер-часы (мАч).
Этот LiPo аккумулятор рассчитан на 1000 мАч, что означает, что он может обеспечить 1 ампер в течение 1 часа, прежде чем он будет считаться разряженным.
Большинство графиков разряда батареи показывают зависимость напряжения батареи от емкости, например, эти тесты батареи AA, проведенные PowerStream. Чтобы выяснить, достаточно ли емкости аккумулятора для питания вашей схемы, найдите самое низкое допустимое напряжение и найдите соответствующий номинал мАч или Ач.
C-Rate
Многие батареи, особенно мощные литий-ионные, обозначают ток разряда как «C-Rate», чтобы более четко определить характеристики батареи.C-Rate — это скорость разряда относительно максимальной емкости аккумулятора.
1С — это количество тока, необходимое для разрядки аккумулятора за 1 час. Например, аккумулятор емкостью 400 мАч, обеспечивающий ток 1С, будет обеспечивать 400 мА. 5C для той же батареи будет 2 A.
Большинство батарей теряют емкость при более высоком потреблении тока. Например, этот график информации о продукте от Chargery показывает, что их LiPo-элемент имеет меньше мАч при более высоких показателях C-Rates.
ПРИМЕЧАНИЕ: Общий совет гласит, что вы должны заряжать LiPo батареи при 1С или меньше.
MIT предлагает фантастическое руководство по спецификациям и терминологии аккумуляторов, которое идет намного дальше этого обзора.
Использование
Однокамерный
Некоторые схемы могут питаться от одного элемента, но убедитесь, что батарея может обеспечивать достаточное напряжение и ток.
Этот щит фотонной батареи питается от одного элемента LiPoЕсли напряжение слишком высокое или слишком низкое для вашей схемы, вам, вероятно, понадобится преобразователь постоянного тока в постоянный.
серии
Чтобы увеличить напряжение между выводами батареи, вы можете расположить элементы последовательно. Последовательность означает штабелирование ячеек встык, соединение анода одного с катодом следующего.
Последовательно соединяя батареи, вы увеличиваете общее напряжение. Сложите напряжение всех ячеек, чтобы определить рабочее напряжение. Емкость остается прежней.
В этом примере четыре ячейки на 1,5 В подключены последовательно.Напряжение на нагрузке составляет 6 В, а общий набор аккумуляторов имеет емкость 2000 мАч.
В большинстве бытовых электронных устройств, в которых используются щелочные батареи, батареи устанавливаются последовательно. Например, этот держатель батареек 2x AA может поднять номинальное напряжение до 3 В для проекта.
ПРИМЕЧАНИЕ: Если вы заряжаете литий-ионные или литий-полимерные батареи последовательно, вам необходимо использовать специальные схемы, известные как «балансировщик», чтобы гарантировать равномерное напряжение между элементами.Некоторые зарядные устройства, такие как это, имеют балансиры для безопасной зарядки.Параллельный
Если напряжение одного элемента соответствует нагрузке, вы можете добавить батареи параллельно, чтобы увеличить емкость. Обратите внимание, что это также означает увеличение доступного тока (C-Rate).
Будьте осторожны при параллельном подключении аккумуляторов! Все элементы должны иметь одинаковое номинальное напряжение и одинаковый уровень заряда. В случае разницы напряжений может произойти короткое замыкание, что приведет к перегреву и, возможно, возгоранию.
В этом примере четыре ячейки 1,5 В подключены параллельно. Напряжение на нагрузке остается на уровне 1,5 В, но общая емкость увеличивается до 8000 мАч.
Серияи параллельный
Если вы хотите увеличить напряжение и емкость, вы можете комбинировать последовательные и параллельные батареи. Еще раз убедитесь, что уровень напряжения одинаков для батарей, включенных параллельно, так как может произойти короткое замыкание.
В этом примере полное напряжение на нагрузке составляет 3 В, а общая емкость аккумуляторов составляет 4000 мАч.
В больших аккумуляторных блоках, особенно литий-ионных, вы часто видите конфигурацию, указанную с использованием «S» и «P» для последовательного и параллельного подключения. Конфигурация для схемы выше — 2S2P. В качестве практического примера современные электромобили используют массивные массивы батарей, соединенных последовательно и параллельно.
Ресурсы и дальнейшее развитие
К настоящему времени вы должны понимать, как были изобретены батареи и как они работают. Батареи — это один из способов обеспечения вашего проекта электроэнергией, и они могут быть невероятно полезны, если вам нужен портативный источник питания.
Если вы хотите больше узнать о батареях, вот еще несколько уроков:
Хотите увидеть аккумуляторы в действии? Взгляните на эти проекты, в которых используются разные батареи в разных конфигурациях:
Simon Splosion Wireless
Это учебное пособие, демонстрирующее один из многих методов «взлома» Саймона Сэйса. Мы выделим технику, чтобы взять ваш Simon Says Wireless.
Как работает аккумулятор?
Энергия не может быть создана или уничтожена, но может быть сохранена в различных формах.Один из способов его хранения — использование в батарее химической энергии. При включении в цепь батарея может вырабатывать электричество.
Батареи преобразуют химическую энергию в электрическую |
Батарея имеет два конца — положительный полюс (катод) и отрицательный полюс (анод). Если соединить две клеммы проводом, образуется цепь. Электроны будут течь по проводу, и будет производиться электрический ток.Внутри батареи происходит реакция между химическими веществами. Но реакция происходит только при наличии потока электронов. Батареи можно хранить в течение длительного времени и при этом продолжать работать, потому что химический процесс не начинается до тех пор, пока электроны не потекут с отрицательной клеммы на положительную по цепи.
В батарее происходит химическая реакция
Простой пример — лимонная батарея
Начнем с очень простой батареи, в которой используется лимон, в который вставлены два разных металлических предмета, например гальванизированный гвоздь и медная монета или проволока.Медь служит положительным электродом или катодом, а гальванизированный (оцинкованный) гвоздь — отрицательным электродом или анодом, производящим электроны. Эти два объекта работают как электроды, вызывая электрохимическую реакцию, которая генерирует небольшую разность потенциалов.
Поскольку атомы меди (Cu) притягивают электроны больше, чем атомы цинка (Zn), если вы поместите кусок меди и кусок цинка в контакт друг с другом, электроны перейдут от цинка к меди. Когда электроны концентрируются на меди, они отталкиваются друг от друга и останавливают поток электронов от цинка к меди.С другой стороны, если вы поместите полоски цинка и меди в проводящий раствор и соедините их снаружи проводом, реакции между электродами и раствором позволят электронам непрерывно течь через провод.
ЛИМОННАЯ БАТАРЕЯ | Как работает лимонная батарейка? Лимонная батарея состоит из лимона и двух металлических электродов из разных металлов, таких как медный пенни или проволока и гальванизированный (оцинкованный) гвоздь. Энергия для батареи исходит не от лимона, а от химического превращения цинка (или другого металла). Цинк окисляется внутри лимона, обмениваясь некоторыми из его электронов, чтобы достичь более низкого энергетического состояния, и высвобождаемая энергия обеспечивает энергию. Лимон просто создает среду, в которой это может произойти, но они не расходуются в процессе. Если предположить, что используются цинковые и медные электроды (например, медная монета и оцинкованный гвоздь), то один лимон может произвести приблизительно 0.9 Вольт. Слева последовательная цепь лимонов показывает, что вырабатывается напряжение 3,41 вольт. ПРИМЕЧАНИЕ: Можно использовать картофель, яблоки, квашеную капусту или любые другие фрукты или овощи, содержащие кислоту или другой электролит, но лимоны предпочтительнее из-за их более высокой кислотности. Например, в картофеле электролитом является фосфорная кислота, а в лимонах — лимонная кислота. |
В лимонной батарее происходит как окисление (потеря электронов), так и восстановление (увеличение количества электронов).Эта батарея похожа на оригинальные «простые гальванические элементы», изобретенные Алессандро Вольта (см. Ниже). На аноде металлический цинк окисляется и попадает в кислый раствор в виде ионов Zn2 +:
Zn -> Zn2 + + 2 е-
На медном катоде ионы водорода (сольватированные протоны из кислого раствора в лимоне) восстанавливаются с образованием молекулярного водорода:
2H ++ 2e- -> h3
Что заставляет электроны двигаться?
Когда вы отпускаете мяч, который вы держите, он падает на землю, потому что гравитационное поле Земли тянет мяч вниз.Точно так же заряженным частицам, таким как электроны, необходимо проделать работу, чтобы переместить их из одной точки в другую. Количество работы на единицу заряда называется разностью электрических потенциалов между двумя точками. Единица измерения разности потенциалов называется вольт.
Разность потенциалов между катодом и анодом возникает в результате химической реакции. Внутри батареи электроны подталкиваются химической реакцией к положительному концу, создавая разность потенциалов.
Именно эта разность потенциалов движет электроны по проводу.
Разница потенциалов может быть положительной или отрицательной, похожей на гравитационную энергию при движении вверх или вниз по холму. В батарее поток электронов идет вниз … электроны могут течь вверх, как в случае зарядного устройства.
Почему электроны просто не перемещаются от анода к катоду внутри батареи?
Электролит в батарее не дает одиночным электронам идти прямо от анода к катоду внутри батареи.Когда клеммы соединены проводящим проводом, электроны могут легко перетекать от анода к катоду.
В каком направлении движутся электроны в проводе?
Электроны заряжены отрицательно, поэтому они будут притягиваться к положительному концу батареи и отталкиваться отрицательным концом. Когда батарея подключена к устройству, которое позволяет электронам проходить через нее, они текут от отрицательного (анода) к положительному (катодному) выводу.
Кто изобрел электрохимический элемент (батарею)?
ПЕРВАЯ БАТАРЕЯ VOLTA | Аккумулятор Volta считается первым электрохимическим элементом. Он состоит из двух электродов: один из цинка, другой из меди. Электролит — серная кислота или смесь соли и воды. Электролит существует в форме 2H + и SO42-.Цинк, содержание которого в электрохимическом ряду выше, чем у меди и водорода, вступает в реакцию с отрицательно заряженным сульфатом SO42-. Положительно заряженные ионы водорода (протоны) захватывают электроны из меди, образуя пузырьки газообразного водорода h3. Это делает цинковый стержень отрицательным электродом, а медный стержень — положительным электродом. Теперь у нас есть две клеммы, и ток будет течь, если мы их соединим. Реакции в этой ячейке следующие: цинк Zn -> Zn2 + + 2e- серная кислота 2H + + 2e- -> h3 Медь не вступает в реакцию, действуя как электрод для химической реакции. |
Как работает современный аккумулятор (угольно-цинковый)?
Сухой цинк-углеродный элемент или батарея упакованы в цинковую банку, которая служит одновременно контейнером и отрицательной клеммой (анодом). Положительный вывод представляет собой углеродный стержень, окруженный смесью диоксида марганца и углеродного порошка. Используемый электролит представляет собой пасту из хлорида цинка и хлорида аммония, растворенных в воде.Углеродный (графитовый) стержень — это то, что собирает электроны, выходящие из анодной части батареи, чтобы вернуться к катодной части батареи. Углерод является единственным практичным проводящим материалом, потому что любой обычный металл быстро разъедает положительный электрод в солевом электролите. Цинк окисляется в соответствии со следующим полууравнением. Диоксид марганца смешивают с углеродным порошком для увеличения электропроводности.Реакция протекает следующим образом: 2MnO2 (s) + 2 e- + 2Nh5Cl (водн.) -> и CL сочетается с Zn2 +. В этой полуреакции марганец восстанавливается со степени окисления (+4) до (+3). Возможны и другие побочные реакции, но общую реакцию в углеродно-цинковом элементе можно представить как: Zn (тв) + 2MnO2 (тв) + 2Nh5Cl (водный раствор) —> Mn2O3 (тв) + Zn (Nh4) 2Cl2 (водный раствор) + h3O (l) Батарея имеет эл.м.ф. около 1,5 В. |
Какие бывают типы батарей?
В разных типах батарей используются различные химические вещества и химические реакции. Вот некоторые из наиболее распространенных типов батарей:
Щелочная батарея | Используется в Duracell® и Energizer® и других щелочных батареях.Электроды из цинка и оксида марганца. Электролит представляет собой щелочную пасту. |
Свинцово-кислотный аккумулятор | Они используются в автомобилях. Электроды изготовлены из свинца и оксида свинца с сильной кислотой в качестве электролита. |
Литиевая батарея | Эти батарейки используются в фотоаппаратах для лампы-вспышки.Они сделаны из лития, иодида лития и иодида свинца. Они могут подавать скачки электричества для вспышки. |
| Литиевая батарея | Эти батарейки используются в фотоаппаратах для лампы-вспышки. Они сделаны из лития, иодида лития и иодида свинца. Они могут подавать скачки электричества для вспышки. |
| Литий-ионный аккумулятор | Эти батареи используются в портативных компьютерах, сотовых телефонах и другом портативном оборудовании с высокой нагрузкой. |
| Никель-кадмиевый или никель-кадмиевый аккумулятор | Электроды из гидроксида никеля и кадмия. Электролит — гидроксид калия. |
| Угольно-цинковая батарея или стандартная угольная батарея — | Цинк и углерод используются во всех обычных или стандартных сухих батареях AA, C и D. Электроды изготовлены из цинка и углерода, между которыми находится паста из кислотных материалов, служащая электролитом. |
ССЫЛКИ И ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Potato Power: Руководство для учителя
История батареи
Электрохимические реакции
Углеродно-цинковая батарея
Углеродно-цинковая батарея — Как они работают?
Как работают батареи Анимированное руководство по науке об аккумуляторах
Оценка Вопросы:
M крайний Вопросы на выбор
Батареи, схемы и трансформаторы — U.S. Управление энергетической информации (EIA)
Батареи производят электроэнергию
Электрохимическая батарея вырабатывает электричество из двух разных металлов в химическом веществе, называемом электролитом . Один конец батареи прикреплен к одному из металлов, а другой конец — к другому металлу. Химическая реакция между металлами и электролитом освобождает больше электронов в одном металле, чем в другом.
Источник: адаптировано из Национального проекта развития энергетического образования (общественное достояние)
Металл, который высвобождает больше электронов, приобретает положительный заряд, а другой металл — отрицательный.Если электрический провод или провод , или провод, соединяет один конец батареи с другим, электроны проходят через провод, чтобы сбалансировать электрический заряд.
Электрическая нагрузка — это устройство, которое использует электричество для выполнения работы или выполнения работы. Если электрическая нагрузка — например, лампа накаливания — размещена вдоль провода, электричество может работать, поскольку оно течет через провод и лампочку. Электроны текут от отрицательного конца батареи через провод и лампочку и обратно к положительному концу батареи.
Электроэнергия передается по цепям
Электричество должно пройти полный путь, или электрическая цепь , прежде чем электроны смогут двигаться. Выключатель или кнопка включения-выключения на всех электрических устройствах замыкает (включает) или размыкает (выключает) электрическую цепь в устройстве. Выключение или выключение света размыкает цепь, и электроны не могут проходить через свет. Включение света замыкает цепь, что позволяет электричеству течь от одного электрического провода через лампочку, а затем через другой провод.
Лампа накаливания излучает свет, когда электричество проходит через крошечный провод в лампочке, который становится очень горячим и светится. Лампа накаливания перегорает, когда крошечный провод внутри лампы обрывается, что приводит к размыканию цепи.
Источник: адаптировано из Национального проекта развития энергетического образования (общественное достояние)
Трансформаторы помогают эффективно перемещать электроэнергию на большие расстояния
Чтобы решить проблему отправки электричества на большие расстояния, Уильям Стэнли разработал устройство под названием трансформатор .Трансформатор изменяет электрическое напряжение в проводе или линии электропередачи. Линии передачи высокого напряжения, например те, которые проходят между высокими металлическими башнями, переносят электричество на большие расстояния туда, где это необходимо. Электроэнергия более высокого напряжения более эффективна и менее дорога для передачи электроэнергии на большие расстояния. Электричество более низкого напряжения безопаснее для использования в домах и на предприятиях. Трансформаторы повышают (повышают) или снижают (понижают) напряжение по мере того, как электроэнергия перемещается от электростанций в дома и на предприятия.
Последнее обновление: 8 января 2020 г.
Battery 101: как работает автомобильный аккумулятор?
Вашему автомобилю, как и пульту дистанционного управления от телевизора или красивой электрической зубной щетке, для работы необходим аккумулятор. Когда он умирает, ваша машина не заводится, в результате чего вы либо застрянете, либо застрянете дома. Вы знаете, что автомобильный аккумулятор важен, но действительно ли вы понимаете, как он питает ваш двигатель, фары и радио? Мы разберем сложность батареи и объясним, как работают автомобильные батареи! Если знания — это сила, вы будете в отличной форме.
Что такое аккумулятор?
Прежде чем углубляться в детали автомобильных аккумуляторов, давайте посмотрим, как аккумуляторы в целом работают. По словам сотрудников НАСА, аккумулятор — это «устройство, преобразующее химическую энергию в электричество». Батареи состоят из ячеек. Эти клетки и содержат настоящую энергию. Они накапливают химическую энергию и по команде преобразуют ее в электрическую. Это то, что питает ваши устройства, от пульта телевизора до электрической зубной щетки.
Как работают автомобильные аккумуляторы?
Большинство автомобильных аккумуляторов основываются на свинцово-кислотной химической реакции, которая заставляет вещи двигаться и обрабатывать канавки. Эти аккумуляторы относятся к категории «SLI». SLI означает «запуск, освещение и зажигание». Этот тип батареи обеспечивает короткие всплески энергии для питания ваших фонарей, аксессуаров и двигателя. Как только аккумулятор пробуждает двигатель к жизни, питание для автомобиля подается от генератора.Большинство автомобилей поставляются с заводской стандартной батареей SLI. Узнайте больше о других типах автомобильных аккумуляторов.
Как работают автомобильные аккумуляторы
Нужен ли мне новый автомобильный аккумулятор?
Вы могли бы! Несмотря на то, что свинцово-кислотные батареи чрезвычайно надежны, несмотря на перепады температуры, движение и стесненные условия под вашим капотом, типичный аккумулятор прослужит всего около трех-пяти лет.

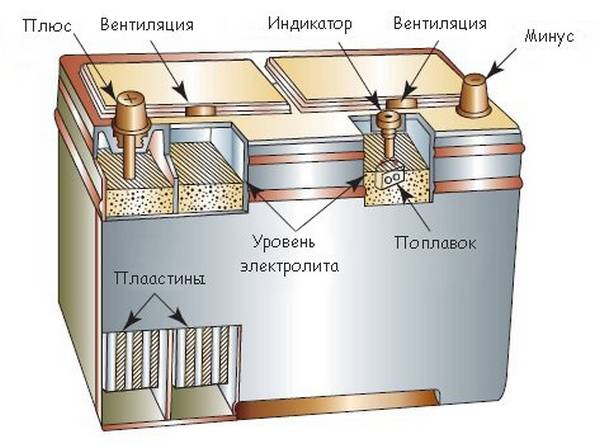 Это нормальное явление.
Это нормальное явление.

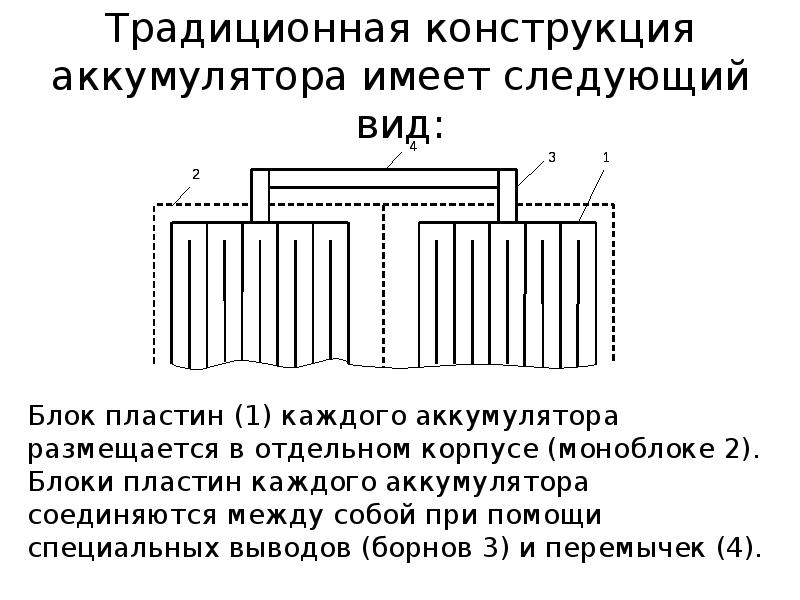 Подзаряжайте аккумулятор каждые три месяца до 50%, чтобы предотвратить повреждение аккумулятора из-за чрезмерной разрядки из-за длительного хранения без использования.
Подзаряжайте аккумулятор каждые три месяца до 50%, чтобы предотвратить повреждение аккумулятора из-за чрезмерной разрядки из-за длительного хранения без использования.
