Аккумуляторная батарея как работает – как работает и принципы его устройства. Автомобильный аккумулятор Аккумуляторы как они работают
- 10.01.2018
Принцип работы аккумулятора
Аккумуляторы — это химические источники тока с обратимым процессом: они могут отдавать энергию, преобразуя химическую энергию в электрическую, или накапливать энергию, преобразуя электрическую энергию в химическую. Таким образом, аккумулятор попеременно то разряжается, отдавая электрическую энергию, то заряжается от какого-либо соответствующего источника постоянного тока.

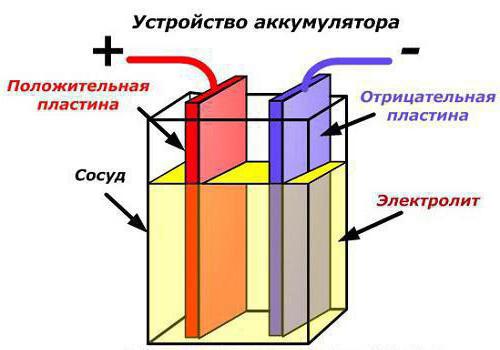
Схема сборки аккумулятора.
Аккумуляторы, в зависимости от применяемого в них электролита, подразделяются на кислотные и щелочные. Кроме того, аккумуляторы различаются, в зависимости от материала электродов. Широкое применение имеют лишь свинцовые, кадмиево-никелевые, железо-никелевые и серебряно-цинковые аккумуляторы.
Емкость аккумулятора определяется количеством электричества qp, которое он может отдать при разряде в питаемую цепь.
Это количество электричества измеряется не в кулонах, а в более крупных единицах — ампер-часах (а-ч). 1 а-ч = 3600 кл. Но для заряда аккумулятора требуется большее количество электричества q3, чем отдаваемое при разряде. Отношение qp : q3 =ne называется отдачей аккумулятора по емкости.
Напряжение, необходимое для заряда аккумулятора, значительно выше того напряжения на зажимах аккумулятора, при котором он отдает длительно разрядный ток.

Схема устройства аккумулятора.
Важной характеристикой аккумулятора являются его средние зарядное и разрядное напряжения.
Ясно, что из-за ряда потерь энергии аккумулятор отдает при разряде значительно меньшее количество энергии Wp, чем получает при заряде. Отношение Wp : W3= n есть коэффициент полезного действия или отдача по энергии аккумулятора.
Наконец, весьма важной для характеристики аккумулятора величиной является его удельная э н е р г и я, т. е. количество энергии, отдаваемой при разряде, приходящееся на 1 кг веса аккумулятора. Особенно существенно, чтобы удельная энергия была возможно больше у нестационарных аккумуляторов, устанавливаемых, например, на самолетах. В подобных случаях обычно она важнее, чем коэффициент полезного действия и отдача по емкости.
Следует иметь в виду, что при медленном разряде процесс в аккумуляторе протекает равномерно во всей массе пластин, благодаря чему при длительном разряде малым током емкость аккумулятора больше, чем при кратковременном разряде большим током. При быстром разряде процесс в массе пластин отстает от процесса на их поверхности, что вызывает внутренние токи и уменьшение отдачи.
Напряжение аккумулятора существенно изменяется во время разряда. Желательно, чтобы оно было возможно более постоянным. В расчетах обычно указывается среднее разрядное напряжение U

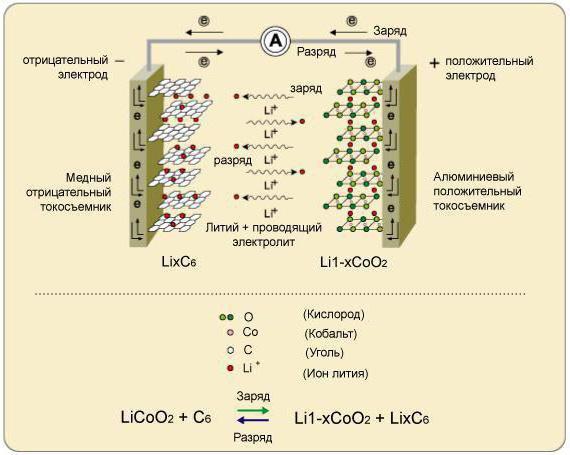
Схема литиево-кислородного аккумулятора.
Если напряжение одного аккумуляторного элемента недостаточно для данной установки, то необходимое число аккумуляторных элементов соединяется последовательно. Конечно, последовательно соединять можно только аккумуляторы, рассчитанные на одну и ту же разрядную силу тока.
Если разрядный ток одного элемента недостаточен, то применяется параллельное соединение нескольких одинаковых элементов.
Из числа кислотных аккумуляторов практическое значение имеют лишь свинцовые аккумуляторы. В них на положительном электроде активным веществом служит двуокись свинца РЬ02, на отрицательном электроде — губчатый свинец РЬ. Положительные пластины имеют бурый цвет, отрицательные— серый, в качестве электролита применяется раствор серной кислоты H2S04 с с удельным весом 1,18—1,29.
Химический процесс разряда и заряда свинцового аккумулятора относительно сложен. В основном он сводится к восстановлению свинца на положительном электроде и окислению губчатого свинца на отрицательном электроде в закисную соль серной кислоты. При этом образуется вода и, следовательно, плотность электролита уменьшается. При разряде сначала напряжение аккумулятора быстро падает до 1,95 В, а затем медленно понижается до 1,8 В. После чего необходимо прекратить разряд.
При дальнейшем разряде имеет место необратимый процесс образования кристаллического сернокислого свинца PbS4. Последний покрывает пластины белым налетом. Он обладает большим удельным сопротивлением и почти не растворим в электролите. Слой сернокислого свинца увеличивает внутреннее сопротивление активной массы пластин. Такой процесс называется сульфатацией пластин.
При заряде аккумулятора процесс идет в обратном направлении: на отрицательном электроде восстанавливается металлический свинец, а на положительном электроде свинец окисляется до двуокиси РЬ0

Схема зарядки аккумулятора.
Внутреннее сопротивление rBн свинцовых аккумуляторов, благодаря малому расстоянию между пластинами и большой площади их соприкосновения с электролитом, весьма мало: порядка тысячных долей ома у стационарных аккумуляторов и сотых долей у небольших переносных аккумуляторов.
Вследствие малого внутреннего сопротивления и относительно большого напряжения КПД этих аккумуляторов достигает 70— 80 %, а отдача — 0,85—0,95 %.
Однако из-за малого внутреннего сопротивления в свинцовых аккумуляторах при коротких замыканиях возникают токи очень большой силы, что приводит к короблению и распаду пластин.
Свинцовые аккумуляторы обладают рядом существенных недостатков. Они тяжелы из-за большого веса свинца пластин, и их объем велик из-за значительного количества электролита, активно участвующего в процессе. В них неизбежен саморазряд внутренними паразитными электрическими токами с потерей заряда порядка 1 % в сутки. Наконец, они весьма чувствительны к толчкам и сотрясениям. Но их отдача и КПД значительно выше, чем у любых других аккумуляторов.
Из числа щелочных аккумуляторов широкое применение в настоящее время имеют кадмиево-никелевые, железо- никелевые и серебряно-цинковые. Во всех этих аккумуляторах электролитом служит щелочь — примерно двухпроцентный раствор едкого калия КОН или едкого натра NaOH. При заряде и разряде этот электролит почти не претерпевает изменений. Следовательно, от его количества емкость аккумулятора не зависит. Это дает возможность свести к минимуму количество электролита во всех щелочных аккумуляторах и таким путем существенно их облегчить.
Остовы положительной и отрицательной пластин этих аккумуляторов делаются из стальных никелированных рамок с пакетами для активной массы. Благодаря такой конструкции активная масса прочно удерживается в пластинах и не выпадает при толчках.

Схема устройства пластин свинцового аккумулятора.
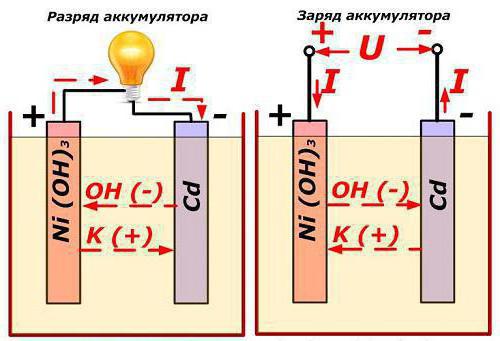
В кадмиево-никелевом КН аккумуляторе активным веществом положительного электрода служат окислы никеля, смешанные для увеличения электропроводности с графитом; активным веществом отрицательного электрода является губчатый металлический кадмий Cd. При разряде на положительном электроде расходуется часть активного кислорода, содержащегося в окислах никеля, а на отрицательном электроде окисляется металлический кадмий. При заряде обратно обогащается кислородом положительный электрод: гидрат закиси никеля Ni(OH)2 переходит в гидрат окиси никеля Ni(OH)3. На отрицательном электроде гидрат закиси кадмия восстанавливается в чистый кадмий. Приближенно процесс в этом аккумуляторе может быть выражен химической формулой:
разряд
2Ni (ОН)3 + 2КОН + Cd ??2Ni (ОН)2 + 2КОН + Cd (ОН)2.
заряд
Как показывает формула, из электролита при разряде выделяется частица (ОН)2 на отрицательной пластине и такая же частица переходит в электролит на положительной пластине. При заряде процесс идет в обратном направлении, но в обоих случаях электролит не изменяется.
Устройство железо-никелевого аккумулятора отличается лишь тем, что в нем в отрицательных пластинах кадмий заменен мелким порошком железа (Fe). Химический процесс этого аккумулятора можно проследить по вышеприведенному для кадмиево-никелевого аккумулятора уравнению путем замены Cd на Fe.
Применение железа вместо кадмия удешевляет аккумулятор, делает его более прочным механически и увеличивает срок его службы. Но с другой стороны, у железо-никелевого аккумулятора при том же примерно разрядном напряжении зарядное напряжение на 0,2 В выше, вследствие чего КПД этого аккумулятора ниже, чем кадмиево-никелевого. Затем очень важным недостатком железо-никелевого аккумулятора является относительно быстрый саморазряд. У кадмиево-никелевого аккумулятора саморазряд мал, и поэтому ему отдается предпочтение в тех случаях, когда аккумулятор должен длительно находиться в заряженном состоянии, например для питания радиоустановок. Среднее разрядное напряжение обоих этих аккумуляторов равно 1,2 В.

Схема железоникелевого аккумулятора.
Герметически закрытые сосуды вышеописанных щелочных аккумуляторов выполняются из листовой никелированной стали. Болты, через которые пластины аккумуляторов соединяются с внешней целью, пропускаются через отверстия в крышке сосуда, причем болт, с которым соединены отрицательные пластины, тщательно изолирован от стального корпуса; но болт, соединенный с положительными пластинами, от корпуса не изолируется.
Внутреннее сопротивление щелочных аккумуляторов значительно больше, чем кислотных, благодаря этому они лучше переносят короткие замыкания. Но по той же причине КПД щелочных аккумуляторов (порядка 45%) значительно ниже, чем кислотных, также существенно меньше их удельная энергия и отдача по емкости (0,65). Так как состояние электролита у щелочных аккумуляторов при работе не изменяется, то определить их степень заряженности по внешним признакам нельзя. Вследствие чего за зарядом приходится следить на основании их емкости и напряжения. При заряде нужно сообщить аккумулятору количество электричества It=q значительно большее, чем его емкость, примерно в 1,5 раза. Например, аккумулятор емкостью 100 а-ч желательно заряжать током силой в 10 а в течение 15 час.
http://fazaa.ru/www.youtube.com/watch?v=DuZSNfTNDyg
Серебряно-цинковые аккумуляторы являются новейшими из числа современных аккумуляторов. Электролитом в них служит водный раствор едкого калия КОН с удельным весом 1,4, с активным веществом положительного электрода (окисью серебра Ag20) и отрицательного электрода (цинком Zn). Электроды изготавливаются в виде пористых пластин и отделяются друг от друга пленочной перегородкой.
При разряде аккумулятора окись серебра восстанавливается до металлического серебра, а металлический цинк окисляется до окиси цинка ZnO. Обратный процесс происходит при заряде аккумулятора. Основная химическая реакция выражается формулой
разряд
AgsO + КОН + Zn ?? 2Ag + КОН + ZnO.
заряд
http://fazaa.ru/www.youtube.com/watch?v=0jbnDTRtywE
Устойчивое разрядное напряжение составляет около 1,5 В. При небольших токах разряда это напряжение почти не изменяется в течение примерно 75— 80% времени работы аккумулятора. Затем оно довольно быстро падает, и при напряжении 1 в разряд следует прекращать.
Внутреннее сопротивление серебряно-цинковых аккумуляторов существенно меньше, чем остальных щелочных аккумуляторов. При равной емкости первые значительно легче. Они удовлетворительно работают как при пониженной (—50° С), так и при повышенной ( + 75° С) температурах. Наконец, они допускают большие разрядные токи. Например, некоторые типы таких аккумуляторов можно разогреть током короткого замыкания в течение одной минуты.
http://fazaa.ru/www.youtube.com/watch?v=bW_5q7saSR8
Выше изложены только основные сведения по аккумуляторам. При практической работе с аккумуляторами, в особенности со свинцовыми, необходимо тщательно выполнять соответствующие заводские инструкции. Нарушение их вызывает быстрое разрушение аккумуляторов.
Принцип работы аккумулятора
Для обеспечения электрическим током схем мобильных устройств и машин, применяются специальные изделия, способные аккумулировать энергию. Для того чтобы правильно эксплуатировать такие устройства, желательно ознакомиться с принципом работы батарей.
История развития АКБ


Первые электрические батарейки на основе солевого электролита были известны ещё в Древнем Багдаде, но новый толчок к развитию этой технологии был получен в начале XIX века.
Итальянский учёный Алессандро Вольта более 200 лет назад создал первый химический источник электрического тока.
Батарейку такой конструкции нельзя было перезарядить, но начиная с этого момента был заложен основательный фундамент изготовления портативных АКБ. Спустя некоторое время, изобретение Вольта были усовершенствованы Иоганном Вильгельмом Риттером, который собрал из медных пластин аккумулятор, который можно было использовать многократно.История развития автомобильного аккумулятора началась значительно позже, ведь во времена Алессандро Вольта самоходные повозки ещё не были изобретены. Даже после появления автомобилей, в которых воспламенение горючей смеси осуществлялось за счёт искровой свечи, большой необходимости в использовании аккумуляторных батарей не было, ведь генерация высокого напряжения осуществлялось с помощью механического магнето. В те времена пуск двигателя осуществлялся вручную, а мощность моторов была не настолько велика, чтобы сопротивление сжатия газа в цилиндрах существенно препятствовала проворачиванию коленвала с помощью специальной рукоятки.
После изобретения звукового сигнала, фар, стеклоочистителей возникла необходимость в источнике тока, который обеспечил бы автомобиль электричеством в необходимом объёме. Первое время машины не имели генератора, поэтому заряжать источники питания приходилось от сети, но уже в 20-е годы прошлого столетия машина стала оснащаться генератором электрического тока, что позволило осуществлять зарядку батарей во время работы двигателя внутреннего сгорания.
С момента первой установки на машину конструкция АКБ практически не изменялась, но существенной модернизации подверглись материалы, из которых изготавливались аккумуляторы. Пластины первых батарей делали из чистого свинца, который очень быстро покрывался оксидным слоем, что существенно снижало эффективность работы устройства. В дальнейшем, для уменьшения негативных последствий решётки обрабатывались суриком, но большую распространённость получила технология, при которой для производства пластин использовался сурьмяно-свинцовый сплав. В современных батареях проблема окисления решёток решается добавлением в свинец легирующих компонентов. Сплавы свинца и кальция позволяют снизить интенсивность испарения воды, поэтому корпус таких аккумуляторов изготавливается полностью герметичным.
Для чего нужна аккумуляторная батарея


Основное назначение автомобильного аккумулятора – обеспечение электрическим током стартер. Это электрическое устройство приводится в движение, только посредством постоянного тока высокой мощности.
Аккумуляторная батарея легко справляется с такой нагрузкой, кроме этого, изделие позволяет многократно осуществлять запуск двигателя.Также автомобильный аккумулятор принимает непосредственное участие в обеспечении электрическим током таких потребителей, как:- Осветительные приборы.
- Звуковой сигнал.
- Стеклоочистители.
- Сигнализацию.
- Дополнительное электрическое оборудование.
Наибольшая потребность в АКБ возникает во время стоянки, ведь в этот момент генератор не вырабатывает электрический ток, а вся нагрузка полностью ложится на плечи химического элемента питания. Также аккумулятор берёт на себя «обязанность» по обеспечению автомобиля электричеством в момент, когда обороты двигателя слишком малы, чтобы раскрутить якорь генератора до определённых значений.
Если автомобиль с двигателем внутреннего сгорания нуждается в АКБ только в момент запуска, а также при отключённом генераторе, то такая разновидность машин, как электромобили использует электродвижущую силу батареи в качестве основного энергоносителя.
Свинцовые батареи практически не способны эффективно справиться с этой задачей, поэтому для питания мощных электромоторов применяются литий -ионные или кадмиевые батареи.
Принцип работы аккумуляторной батареи
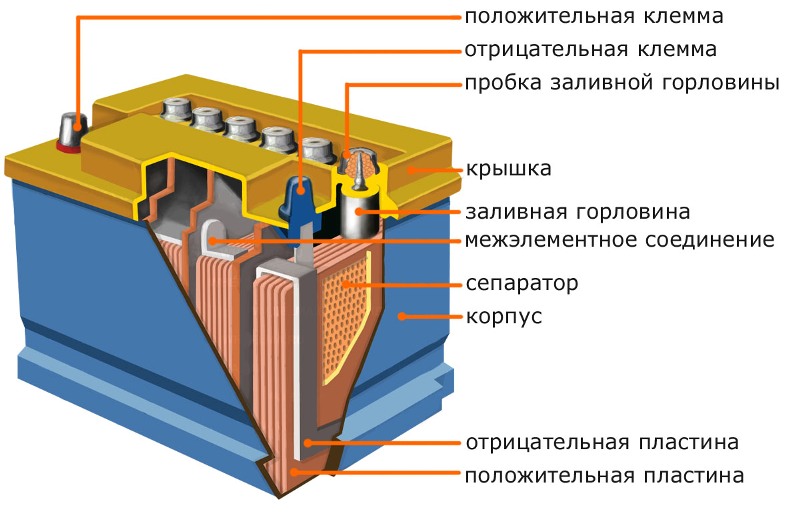

Чтобы понять принцип работы аккумулятора автомобиля необходимо ознакомиться с устройством батареи. Автомобильный аккумулятор состоит из следующих элементов:
- Корпуса.
- Крышки.
- Отрицательных и положительных пластин.
- Сепараторов.
- Клемм.
- Электролита.
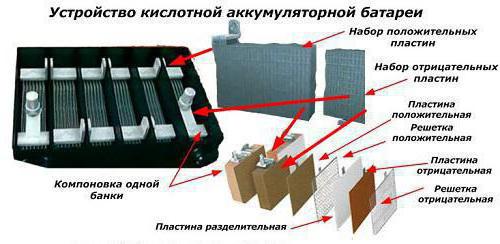
Если аккумулятор является обслуживаемым, то в крышке имеется 6 резьбовых пробок, которые открывают доступ к каждой банке батареи. Корпус современных изделий изготавливается из сверхпрочного пластика, крышка также делается из пластмассы, которая надёжно соединяется с основной коробкой методом пайки. Кроме корпуса, из кислотоустойчивой пластмассы изготавливаются сепараторы, которые устанавливаются между пластинами.
Разобравшись, из чего состоит автомобильный аккумулятор можно приступать к изучению механизма накопления электрического тока. Работа АКБ зависит от возможности протекания химической реакции между свинцовыми пластинами и электролитом.
При подключении к АКБ потребителей электроэнергии происходит окисление свинца на положительной решётке, при этом на отрицательной пластине восстанавливается диоксид свинца.
Если аккумулятор заряжается от генератора или сетевого адаптера, то происходит обратный процесс. То есть, на отрицательных решётках уменьшается количество вещества, а на положительных – увеличивается.Если известно из чего состоит АКБ, а также изучен принцип работы аккумулятора, то не составит большого труда разобраться в особенностях современных разновидностей таких изделий.
Типы современных АКБ


Устройство современного аккумулятора автомобиля отличается от источников тока, изготавливаемых в прошлом столетии, прежде всего, по наличию необслуживаемого корпуса. Практически все АКБ, предназначенные для легкового автотранспорта, выпускаются без пробок в верхней крышке. К такому технологическому решению удалось прийти только после того, как было снижено газообразование внутри корпуса батареи. Таким неоспоримым достоинством обладают АКБ следующих типов:
- Кальциевые (Ca/Ca).
- Гибридные.
- Гелевые.
- Литий-ионные.
- Щелочные.
Гибридные АКБ представляют собой средние по качеству батареи. Отрицательные пластины таких аккумуляторов также изготавливаются по кальциевой технологии, а положительные – из сурьмянистого сплава. Гибридные изделия существенно дешевле кальциевых АКБ, а зарядный ток на их контакты можно подавать с использованием даже старых моделей ЗУ.
В гелевой батареи аккумуляторный электролит представляет собой желеобразную массу.
Благодаря такой особенности батарея может прослужить более десяти лет, а при глубоком разряде рабочая поверхность пластин длительное время не будет покрываться оксидным слоем.
Несмотря на перечисленные преимущества, существенным недостатком таких изделий является высокая стоимость.AGM- аккумуляторы представляют собой устройство, которое очень напоминает гелевую конструкцию АКБ. В корпусе из пластика находятся свинцовые пластины, которые погружены в ватоподобную стекловолоконную массу, которая пропитывается электропроводящим составом. Благодаря использованию такой технологии удаётся также добиться низких показателей испарения жидкости, а также устойчивости к механическому воздействию.
Литий-ионные аккумуляторы могут состоять только из ионов этого металла, поэтому при эксплуатации батарей значительно снижается вероятность их воспламенения даже под большой нагрузкой.
Благодаря этому преимуществу их можно использовать не только в качестве накопителя электроэнергии для машин с двигателем внутреннего сгорания, но и как основной источник энергии для электромобилей.
В современных щелочных аккумуляторах, также как и раньше, в качестве электролита используются едкий калий и едкий натрий. Достоинства таких батарей заключается в том, что в процессе эксплуатации не происходит снижения количества химических веществ внутри корпуса. Кроме этого, изделия имеют минимальный саморазряд и длительный срок эксплуатации. В различных самоходных установках такие модели АКБ применяются, в основном, в качестве тяговых аккумуляторов.
Принцип работы аккумулятора несложен, но разобраться в нём всё-таки стоит. Несмотря на то, что в необслуживаемую АКБ невозможно даже долить воды, знание особенностей процесса зарядки и разрядки, позволит не допустить серьёзных ошибок во время эксплуатации батареи.
Принцип работы аккумуляторной батареи | Автомобильный портал
Так как вся автомобильная техника, начиная от копейки заканчивая огромным самосвалом, нуждается в аккумуляторе, то заводам ежегодно приходиться производить сотни тысяч таких устройств. Небольшая закономерность для движения машины нужен заведенный двигатель, а что бы завести двигатель, нужен аккумулятор. Выходит без аккумулятора, который вырабатывает электричество, машина мертва.
Аккумулятор удивительное изобретение человечества. Он может отдать энергии для того, что бы завести двигатель, то есть сгенерировать и когда двигатель в работе он сам ее производит.
Таким образом, при работе двигателя аккумулятор заряжается. Этот небольшой предмет одновременно выполняет две противоположные по значению функции. При этом применяя одни и те же составляющие. Генерирует и аккумулирует электричество. Такой эффект возможный при наличии обратной химической реакции.
Так как же он устроен?
Аккумулятор на верхней крышке имеет два полюса один отрицательный, а другой положительный. К ним присоединяется два провода с плюсом и минусом, которые находиться под капотом в машине. По ним ток распространится по всей машине. Таким образом, работает вся техника на электричестве, которая находиться внутри машины. Начиная от зарядки телефона заканчивая фарами машины.
И самый важный элемент, который требует электричество это стартер. Самый приятный звук для водителя, когда его машина завелась.
Сняв верхнюю крышку аккумулятора можно увидеть шесть элементов, которые вырабатывают то самое электричество. Они похожие на маленькие спрессованные пластины метала. Каждый такой блок имеет набор электродов. Сделанные из восьми пластин, которые перекрываются.
Далее они формируются в одну пластину, где таких уже шестнадцать штук. Количество выработанной энергии зависит от площади пластины. Чем она больше, тем энергии вырабатывается больше. Для экономии места в коробке пластины соединяют внахлест. Такой метод нужен для того, что бы аккумулятор смог поместиться под капотом вашей машины. Для притягивания электрофонов плюс сетки покрывают свинцовым суриком, для отталкивания этих же самых электронов покрывают свинцом.
На дно аккумулятора заливают химический раствор, состоящий на 34% из серной кислоты и на 64% воды. Данная смесь обладает летучестью.
Данный раствор очень опасный, небрежное отношение к нему может закончиться плачевно.
Достаточно одной капли для того, чтобы прожечь насквозь вашу одежду и оставить ожог на руке.
Данная кислота способна на сильные химические реакции, для которых она была изначально и придумана. Эти реакции происходят при разряде аккумулятора. Раствор в сочетании серной кислоты и воды является электролитом способным провести ток. Реакция кислоты начинается в тот момент, когда аккумулятор разряжается или производит электричество.
Так как секции, покрытые свинцовым суриком и свинцом, а они перекрывают друг друга и, попадая в электролит, производят маленькие частицы, которые и имеют название электроны.
Они перемещаются по сеткам, увеличивая вольтаж, с положительной пластины, перебегая на негативную сетку, и вырабатывают электричество. Химический состав преобразовывается при передвижении электронов с одной пластины на другую.
Таким образом, каждая пластина имеет два вольта, пройдя с одной пластины на другую, вольтаж увеличивается вдвое. В результате такой работы на выходе через две пластины получается четыре вольта. Следуя простой математике, когда в обычном аккумуляторе стоит 6 пластин на выходе получается шесть умножить на два равно 12 вольт. При заряде аккумулятора электроны перебегают с одной на другую пластины. Когда цикл заканчивается это значит, он полностью заряжен и готов к работе.
Именно двенадцать вольт хватает, что бы завести мотор двигателя. Как только стартер получает напряжение, включается система топливной подачи бензина в поршень. И уже эта система держит работу двигателя до выключения мотора.
За остальные важные органы электрического управления отвечает генератор переменного тока. При работе двигателя аккумулятор с помощь генератора начинает заряжаться.
Происходит этот процесс через обратную химическую реакцию кислотного раствора, который находиться в аккумуляторе. Через генератор переменного тока поступают электроны сначала в отрицательную пластину, а потом переходят в положительную. Весь химический процесс прекращается и возвращается в исходную массу готовую снова зарядить аккумулятор, а пока, что аккумулятор готов отдавать заряженные от генератора частицы.
Если машина будет без запущенного мотора долгое время заряжать ваш телефон или играть будет аудио аппаратура машины, то аккумулятор сядет без возможности подзарядиться от генератора. И такой аккумулятор придется зарядить вручную.
Так же есть вариант подкурить у другой машины, что бы завести свою, а уже генератор зарядит ваш аккумулятор. Для постоянной работы генератора нужна химическая реакция при заряде и разряде. Она возможна при работе генератора. Таким образом, ваш аккумулятор будет всегда готовым запустить ваш двигатель.
В настоящее время служба аккумулятора составляет от трех до шести лет. Данный промежуток зависит от хозяина машины и состояние самой машины. До шести лет аккумулятор сможет прожить, только если относиться к нему по все нормам и правилам. К тому же основным фактором выступает, насколько новая машина.
Если машина с салона, то ровно шесть лет аккумулятор служить не будет. Так как у него есть строк годности. И нужно учитывать не день покупки. А дату производства аккумулятора.
Зима самый противный период для батарей. Тут очень хорошим примером будет iPhone. У данного устройства на всех моделях есть один минус. Телефон, имея заряд ниже 50% может отключиться, а включиться только в теплом помещении.
Точно так же плохо работает аккумулятор у машины. Просто на морозе тормозит химический процесс внутри устройства. Таки образом замедляя его работу. Но и еще в последствии теряет в емкости.
Как можно заметить аккумулятор iPhone и машины абсолютно разные по технологии и внешнему виду, но проблемы у них общее. Для машины зимой стоять пробке это самое плохое влияние на аккумулятор. Так как генератор пытается его зарядить, а он сопротивляется, потому что у него замедленные химические процессы через сильные морозы. Таким образом, попадая в пробки зимой, батарея быстро теряет в емкости. А сам аккумулятор не будет успевать подзарядиться после холодного пуска.
Купить новый аккумулятор может каждый, зная несколько секретов. Перед покупкой нужно детально изучить старый испорченный аккумулятор. Для начала узнайте его емкость. Это очень важный показатель при покупке. И тут главное понимать, что купив большей емкости или меньшей можно навредить как машине так и новой покупке. Если указано 50 ампер-часов значит нужно покупать имеено 50 ампер-часов. Так же для покупки новой батареи понадобиться высота, длинна и ширина старого. Сфотографируйте или запомните расположение клемм.
И так посмотрели емкость батареи, рекомендованную производителем, измерили размеры, запомнили или сфотографировали клеммы. Теперь можно идти покупать новый аккумулятор.
Купив батарею большей емкость, чем имеет оригинал, генератор автомобиля просто не сможет потянуть такую емкость. А если будет меньшая емкость, то генератор будет устраивать частые цикли перезаряда. Как можно увидеть, в двух случаях гарантирован ускоренный износ батареи.
Очень часто можно увидеть одинаковые батареи с одинаковой емкости, но разные размеры. Для этого и нужны подготовленные заранее размеры старого аккумулятора. Если взять на глаз то может быть проблема, что просто не влезет, под капот вашей машине.
Есть вероятность приобрести просто идеальный аккумулятор подходящей емкости и размеры. Уже установили батарею в машину, осталась одна деталь подключить ее к питанию. И тут если не сделать заранее фотографию клемм, то при подключении будут проблемы. Ведь расположение клемм может быть двух вариантов. При обратном расположении штатные силовые провода просто будут короткими, что бы дотянуться до нужных клемм.
Так же смотрите на дату изготовления батареи. Потому, что отсчет ее жизни, начинается не с момента установки в машину, а с момента запечатывания на заводе производителя в коробку.
Требуйте, что бы консультант магазина перед покупкой проверил работоспособность батареи нагрузочной вилкой. Если окажется, что питание после десяти меньше восьми вольт требуйте заменить аккумулятор на новый. Не забываете просить гарантию на данный товар.
Устройство и принцип работы автомобильного аккумулятора | Полезные статьи
Понравилось видео? Подписывайтесь на наш канал! Автомобиль в наше время перестал быть роскошью и стал средством передвижения. Многих автомобилистов интересуют такие вопросы, как: какие автомобильные аккумуляторы лучшие, устройство автомобильного аккумулятора и принцип его работы. Сегодня в нашей статье мы ответим на эти вопросы, а также расскажем, можно ли зарядить автомобильный аккумулятор.
Автомобиль в наше время перестал быть роскошью и стал средством передвижения. Многих автомобилистов интересуют такие вопросы, как: какие автомобильные аккумуляторы лучшие, устройство автомобильного аккумулятора и принцип его работы. Сегодня в нашей статье мы ответим на эти вопросы, а также расскажем, можно ли зарядить автомобильный аккумулятор.
Устройство автомобильного аккумулятора
Автомобильный аккумулятор состоит из следующих элементов:
• Корпус и крышка из эбонита или кислотостойкого пластика. На крышке располагаются специальные отверстия, через которые заливается электролит и осуществляется дальнейшая дозаливка дистиллированной воды. Заливные отверстия закрываются пробками из полиэтилена, имеющими вентиляционные отверстия для выхода газов при эксплуатации.
• Полюсные выводы – отрицательный и положительный. Для того чтобы не перепутать полярность, выводы имеют разные диаметры (у положительного он больше), а также могут иметь гравировку «+» и «-». Это исключает возможность неправильного подключения электропотребителей к АКБ.
 Под крышкой аккумулятора размещаются:
Под крышкой аккумулятора размещаются:
• Аккумуляторная батарея, состоящая из шести аккумуляторов или, как их еще называют, банок. Банки помещены в электролит – раствор, состоящий из 35% серной кислоты и 65% дистиллированной воды. Электролит необходим для взаимодействия химических элементов и вырабатывания электрического тока.
• Борны, предназначенные для наружного токоотвода. К ним привариваются положительный и отрицательный полюсные выводы.
• Перегородки, обеспечивающие разделение блоков аккумуляторов (банок) друг от друга.
• Полюсные мосты с межэлементными соединителями, при помощи которого выполняется герметичное соединение блоков аккумуляторов через перегородку корпуса.
Банки же в свою очередь состоят из следующих частей:
 • Блок положительных электродов, выполненный из свинцовых решетчатых пластин, на которые нанесена активная масса из диоксида свинца. Все электроды через ушко подсоединены к полюсному мосту.
• Блок положительных электродов, выполненный из свинцовых решетчатых пластин, на которые нанесена активная масса из диоксида свинца. Все электроды через ушко подсоединены к полюсному мосту.• Блок отрицательных электродов из свинцовых решетчатых пластин, в которые впрессована активная масса из мелкопористого свинца. Электроды через ушко, так же подсоединены к соответствующему полюсному мосту.
Стоит отметить, что количество реагента, нанесенного на пластины положительных и отрицательных электродов, определяет такую важную характеристику аккумуляторной батареи, как ее емкость, а площадь поверхности пластин — пусковой ток.
• Сепаратор. Чаще всего представляет собой конверт из мипора, мипласта или полиэтилена. Он обеспечивает разделение участвующих в электрохимических превращениях реагентов, а также обеспечивает возможность диффузии электролита от одного электрода к другому.
Принцип работы аккумуляторной батареи
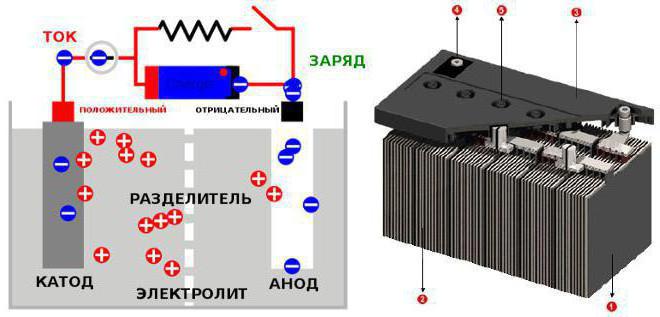
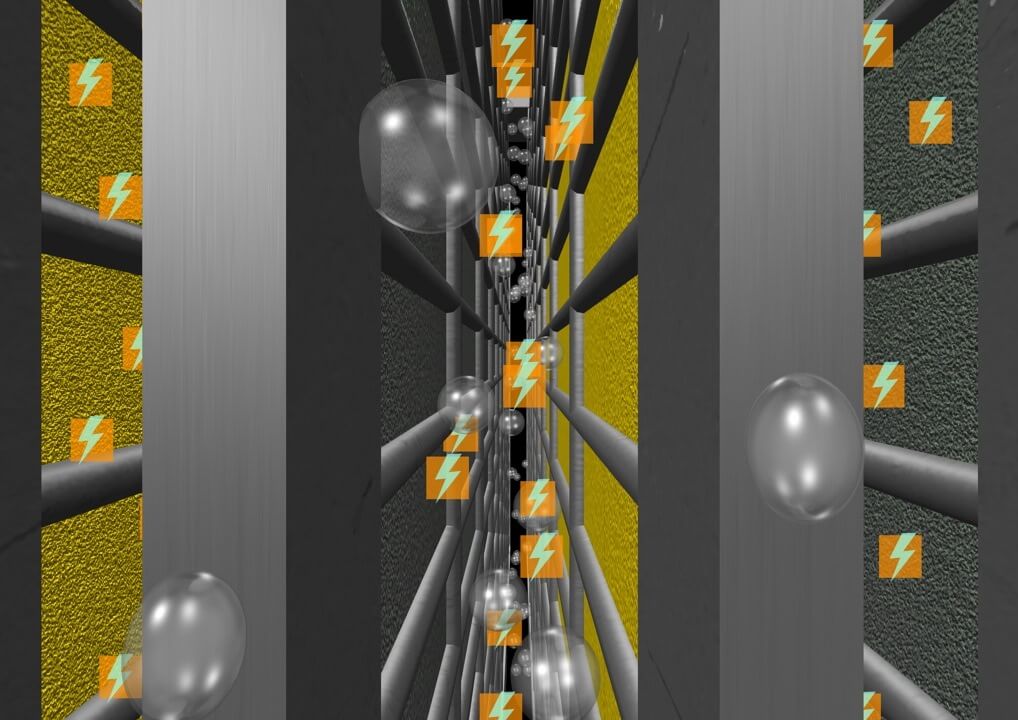 Принцип действия аккумулятора основан на образовании разности потенциалов между двумя электродами, погруженными в электролит. При подключении нагрузки к аккумулятору активное вещество на положительных и отрицательных электродах вступает в химическую реакцию с электролитом, который частично диссоциирован на положительные и отрицательные ионы. Под действием ЭДС аккумулятора электрический ток потечет по направлению от положительного электрода к отрицательному. Электроны, накопившиеся на отрицательном электроде, будут перетекать по внешней цепи в противоположном направлении. Электроны, двигаясь по сеткам электродов, будут вырабатывать электрический ток, при этом в одной банке формируется напряжение около двух Вольт. После того как электроны из первой банки проходят во вторую, они набирают еще два Вольта. Далее все повторяется, пока напряжение автомобильного аккумулятора на выходе не составит 12 Вольт.
Принцип действия аккумулятора основан на образовании разности потенциалов между двумя электродами, погруженными в электролит. При подключении нагрузки к аккумулятору активное вещество на положительных и отрицательных электродах вступает в химическую реакцию с электролитом, который частично диссоциирован на положительные и отрицательные ионы. Под действием ЭДС аккумулятора электрический ток потечет по направлению от положительного электрода к отрицательному. Электроны, накопившиеся на отрицательном электроде, будут перетекать по внешней цепи в противоположном направлении. Электроны, двигаясь по сеткам электродов, будут вырабатывать электрический ток, при этом в одной банке формируется напряжение около двух Вольт. После того как электроны из первой банки проходят во вторую, они набирают еще два Вольта. Далее все повторяется, пока напряжение автомобильного аккумулятора на выходе не составит 12 Вольт.
Важно отметить, что во время разрядки происходит окислительная реакция, которая приводит к образованию на пластинах электродов сульфата свинца и к истощению электролита.
Чтобы выполнить заряд автомобильного аккумулятора, к его борнам необходимо присоединить источник тока, напряжение которого превышает ЭДС аккумулятора. Ток будет протекать через аккумулятор в направлении, обратном току разряда. Электроны будут перетекать от отрицательных электродов к положительным, при этом так же будет восстанавливаться ионный состав электролита.
Как правило, считается, что чем больше емкость АКБ, тем лучше. Однако следует отметить, что при выборе аккумуляторной батареи для своего авто нужно учитывать рекомендации производителя по емкости и напряжению. А значит, «правильный» автомобильный аккумулятор тот, который подобран в соответствии с требуемыми характеристиками.
Мы рассказали об устройстве и принципе работы аккумуляторной батареи. Вы также можете посмотреть наше видео, в котором подробно показано, как устроен АКБ и как она работает.
устройство, эксплуатация, принцип работы и схема
Автономные источники электроэнергии являются одними из самых полезных изобретений человечества. Что такое телефон или радио, в которых не установлены аккумуляторные батареи? Устройство многих приспособлений, а также условия их использования не всегда предусматривают наличие постоянного сетевого электропитания, поэтому такие источники электроэнергии позволяют с комфортом осуществлять свою деятельность практически в любой точке мира. После небольшого предисловия давайте приступим к статье.
Что такое аккумуляторная батарея?
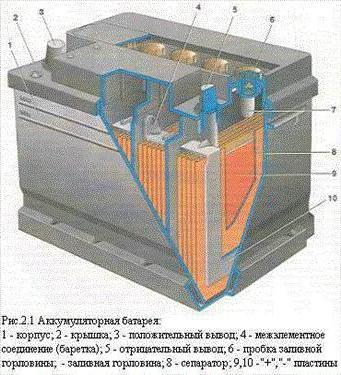 В широком смысле под этим понятием подразумевают устройство, что при одних условиях использования может накапливать какой-либо вид энергии, а при других – расходовать, чтобы удовлетворить нужды человека.
В широком смысле под этим понятием подразумевают устройство, что при одних условиях использования может накапливать какой-либо вид энергии, а при других – расходовать, чтобы удовлетворить нужды человека.Аккумуляторы аккумулируют электричество от внешнего источника питания, а потом отдают её подключенным потребителям, чтобы они смогли делать свою работу. Так, когда устройства работают, постоянно протекают химические реакции между электролитом и электродными пластинами. Кстати, подобная конструкция размещена в банках, из которых и формируются аккумуляторные батареи. Устройство данных конструкций предусматривает создание напряжения, как правило, 1,2-2 В, что весьма мало. Поэтому для увеличения показателей источников питания и применяются разные типы соединения.
Устройство данных источников питания предусматривает подключение к плюсу и минусу. Функционируют они следующим образом: когда к электродам подключается нагрузка (в качестве примера можно рассмотреть лампочку), то возникает замкнутая электрическая цепь. По ней начинает протекать ток разряда. Формируется он благодаря движению электронов, анионов и катионов. Более детальную информацию о том, что и как протекает, можно рассказать только на конкретном примере.
Допустим, что у нас есть аккумулятор, где положительный электрод – это окись никеля, в который был добавлен графит для повышения проводимости. Для отрицательной пластины применяли губчатый кадмий. Так вот, когда идёт разряд, то частицы активного кислорода выделяются и попадают в электролит. При этом от них отделяются части, которые идут как электричество (те же электроны). Затем частицы активного кислорода направляются в сторону отрицательных пластин, где они окисляют кадмий.
Функционирование аккумулятора при заряде
 Необходимо отключить нагрузку на клеммах пластин. На них же подаётся, как правило, постоянное напряжение (но может быть и пульсирующее, зависит от случая), которое больше, чем величина батареи, что заряжается. Причем полярность должна быть одинаковой. То есть минусовые и плюсовые клеммы потребителя и источника обязаны совпадать. Учтите, что зарядное устройство обязательно должно обладать большей мощностью, чем есть в аккумуляторе, чтобы подавлять остатки энергии в нем и создавать электрический ток, направление которого будет противоположным разряду. В результате меняются и химические процессы, которые протекают в аккумуляторной батарее.
Необходимо отключить нагрузку на клеммах пластин. На них же подаётся, как правило, постоянное напряжение (но может быть и пульсирующее, зависит от случая), которое больше, чем величина батареи, что заряжается. Причем полярность должна быть одинаковой. То есть минусовые и плюсовые клеммы потребителя и источника обязаны совпадать. Учтите, что зарядное устройство обязательно должно обладать большей мощностью, чем есть в аккумуляторе, чтобы подавлять остатки энергии в нем и создавать электрический ток, направление которого будет противоположным разряду. В результате меняются и химические процессы, которые протекают в аккумуляторной батарее.Давайте рассмотрим пример из предыдущего подпункта статьи. Здесь уже положительный электрод будет обогащаться кислородом, а на отрицательном восстановится чистый кадмий. Подводя итог, можно сказать, что во время заряда и разряда меняется только химический состав электродов. Это не относится к электролиту. Но он может испаряться, что негативно будет сказываться на времени работы батареи.
Итак, мы рассмотрели принцип работы любого аккумулятора. Теперь давайте узнаем, как во время эксплуатации можно улучшить их характеристики.
Параллельное соединение
Величина тока зависит от значительного количества факторов. В первую очередь под этим понимают конструкцию, применяемые материалы и их габариты. Чем большую площадь имеют электроды, тем большие показатели тока они смогут выдержать. Этот принцип используется для параллельного соединения однотипных банок в аккумуляторах. Такое делается, если необходимо увеличить значение тока, что идёт на нагрузку. Но вместе с этим приходится и поднимать мощность источника энергии.
Последовательное соединение
 Если рассматривать банки, из которых состоят аккумуляторные батареи, то необходимо сказать, что они находятся, как правило, в одном корпусе. Подобный тип соединения используется, чтобы получить большие показатели напряжения с меньшими потерями.
Если рассматривать банки, из которых состоят аккумуляторные батареи, то необходимо сказать, что они находятся, как правило, в одном корпусе. Подобный тип соединения используется, чтобы получить большие показатели напряжения с меньшими потерями.Увидеть применение этой конструкции можно, разобрав автомобильные батареи, которые являются свинцово-кислотными. Стоит сказать, что этот тип применяется не только в устройстве автомобильного аккумулятора, это просто самый вероятный способ разобрать, как же работает подобный тип соединения. В таком случае необходимо позаботится о том, чтобы не было металлического контакта, а существовала надежная гальваническая связь через электролит. Но это только нужно понимать в отношении данного типа. В других случаях по-другому будет реализовываться поставленная задача соединения.
Типы аккумуляторных батарей
 Они разнятся из-за своего предназначения, возможностей, реализации и материала. На данный момент современным производством освоен выпуск больше трех десятков типов, которые отличаются своим составом электродов, а также применяемым электролитом. Так, например, li-ion аккумуляторы могут похвастаться семейством из 12 известных моделей. Условно можно выделить следующие типы:
Они разнятся из-за своего предназначения, возможностей, реализации и материала. На данный момент современным производством освоен выпуск больше трех десятков типов, которые отличаются своим составом электродов, а также применяемым электролитом. Так, например, li-ion аккумуляторы могут похвастаться семейством из 12 известных моделей. Условно можно выделить следующие типы:- Свинцово-кислотные.
- Литиевые.
- Никель-кадмиевые.
Это самые популярные представители. Но для понимания возможностей предлагаем ознакомиться со списком материалов, которые могут выступать в качестве электродов:
- железо;
- свинец;
- титан;
- литий;
- кадмий;
- кобальт;
- никель;
- цинк;
- ванадий;
- серебро;
- алюминий;
- ряд других элементов, которые, впрочем, встречаются очень редко.
Использование разных материалов влияет на получаемые выходные характеристики и, следовательно, на сферу применения. Так, к примеру, li-ion аккумуляторы применяются в компьютерных и мобильных устройствах. Тогда как никель-кадмиевые используются в качестве замены стандартных гальванических элементов. Теоретически все типы аккумуляторных батарей могут работать с любой нагрузкой. Вопрос только в том, насколько оправданным является такое применение.
Основные характеристики
 Мы уже рассмотрели, что такое аккумуляторные батареи, устройство этих конструкций, из чего их делают. Теперь давайте сосредоточимся на том, что влияет на их эксплуатацию. Важными для нас характеристиками являются:
Мы уже рассмотрели, что такое аккумуляторные батареи, устройство этих конструкций, из чего их делают. Теперь давайте сосредоточимся на том, что влияет на их эксплуатацию. Важными для нас характеристиками являются:- Плотностью называют характеристику соотношения количества энергии к объему или весу аккумулятора.
- Емкостью именуют значение максимального заряда аккумулятора, которое он может отдать во время процесса разряда, пока не будет достигнуто наименьшее напряжение. Данный показатель выражается в ампер-часах или кулонах. Также может указываться энергетическая емкость. Она измеряется в ватт-часах или джоулях. Задача такой емкости – сообщать о количестве энергии, что отдаётся во время разряда до достижения минимального допустимого напряжения.
- Температурный режим оказывает влияние на электрические свойства аккумуляторной батареи. Когда есть серьезные отклонения от рекомендованного производителем диапазона эксплуатации, то существует высокая вероятность выхода источника питания из строя. Это объясняется тем, что холод и жара влияют на интенсивность протекания химических реакций, а также на внутреннее давление.
- Саморазрядом именуют потери емкости, которые происходят после заряда батареи, когда отсутствует нагрузка на клеммах. Во многом этот показатель зависит от конструктивного исполнения и может увеличиваться, если нарушилась изоляция.
Вот такие характеристики аккумуляторных батарей и предоставляют для нас наибольший интерес. Конечно, если придётся делать что-то новое и эксклюзивное, ранее невиданное, то может понадобиться и что-то ещё. Но это весьма маловероятно.
Устройство электродов
 В качестве примера мы возьмём свинцовые пластины. Хотя таковыми они были раньше. Современные пластины изготавливаются из свинцово-кальциевого сплава. Благодаря этому достигается низкий уровень саморазряда батареи (50% емкости теряется за 18 месяцев). Также это позволяет экономно расходовать воду (всего 1 грамм на ампер-час).
В качестве примера мы возьмём свинцовые пластины. Хотя таковыми они были раньше. Современные пластины изготавливаются из свинцово-кальциевого сплава. Благодаря этому достигается низкий уровень саморазряда батареи (50% емкости теряется за 18 месяцев). Также это позволяет экономно расходовать воду (всего 1 грамм на ампер-час).Можно встретить и гибридную конструкцию, где, кроме свинца, в положительный электрод добавляется сурьма, а в отрицательный – кальций. Правда, в таких случаях имеется повышенный расход воды. Чтобы повысить стойкость к коррозийным процессам, добавляют олово или серебро.
Электроды изготавливаются с решетчатой структурой, их покрывают слоем активной массы. Принцип работы аккумуляторной батареи в немалой степени зависит от того, какой материал используется для пластин. Мы рассматриваем свинцовые, которые просты для изучения, но ориентироваться на них всегда не рекомендуем.
Электролит
Рассматриваем все те же свинцово-кислотные батареи. В качестве электролита, в который они помещаются, чаще всего выступает серная кислота. Она обладает определённой плотностью, которая может меняться в зависимости от уровня заряда батареи. В данном случае действует принцип: чем больше, тем выше. Со временем электролит улетучивается, и емкость аккумуляторной батареи падает. На сроке службы сказываются особенности эксплуатации (соблюдение техники безопасности). В батареях электролит может быть двух типов:
- жидким;
- в виде пропитанного специального материала.
На данный момент наиболее распространён первый тип.
Эксплуатация аккумуляторных батарей
 Использование аккумуляторов можно наблюдать практически везде. Вспомните свои мобильные телефоны или источники бесперебойного питания для компьютеров. В качестве примера можно привести и обычный фонарик (современные образцы всё чаще изготавливаются со встроенным аккумулятором и не рассчитаны на гальванические элементы). А автомобили? Системы «стоп-старт» и рекуперативного торможения работают от аккумуляторов, причем они выдвигают высокие требования к пусковому току, глубокому разряду и долговечности. Как видите, без этих источников питания сложно обойтись в современной жизни любому человеку.
Использование аккумуляторов можно наблюдать практически везде. Вспомните свои мобильные телефоны или источники бесперебойного питания для компьютеров. В качестве примера можно привести и обычный фонарик (современные образцы всё чаще изготавливаются со встроенным аккумулятором и не рассчитаны на гальванические элементы). А автомобили? Системы «стоп-старт» и рекуперативного торможения работают от аккумуляторов, причем они выдвигают высокие требования к пусковому току, глубокому разряду и долговечности. Как видите, без этих источников питания сложно обойтись в современной жизни любому человеку.Схема построения аккумуляторной батареи
Мы рассмотрели основную информацию о данных устройствах. Давайте ещё уделим внимание такому понятию, как схема аккумуляторной батареи. Ведь в рамках статьи по нему прошлись только вскользь. Аккумулятор современной схемы, согласно истории, был впервые создан французским физиком Гастоном Плантом. Площадь его творения превышала 10 квадратных метров! Современные батареи, по сути, являются просто значительно уменьшенными и немного доработанными копиями его аккумулятора. Видимым для человека элементом является только корпус. Он обеспечивает общность и целостность конструкции.
Как работает аккумулятор?
Знание — сила, особенно, когда дело доходит до аккумулятора Вашего автомобиля и его (автомобиля) электрической системы. На самом деле, если двигатель — сердце нашего автомобиля, то аккумулятор — это его центральная нервная система (а, может быть, даже и душа) — он хранит и производит электроэнергию, а также контролирует силу тока электросети. Последнее, что Вы хотели бы — это остаться на пустынной трассе с умершим аккумулятором. Чем больше Вы знаете об аккумуляторе и электрической системе в целом, тем меньше вероятности попасть в такую ситуацию.
Как работает автомобильный аккумулятор?
Автомобильный аккумулятор обеспечивает всю электросистему машины необходимым количеством электроэнергии для питания всех электрических компонентов в Вашем автомобиле. И речь здесь идёт о довольно огромной ответственности. Без аккумулятора автомобиль, как Вы, наверное, уже поняли, никуда не поедет. Давайте взглянем на то, как работает этот мощный маленький ящик!
Химическая реакция — это главный принцип работы аккумулятора: он попросту преобразует химическую энергию в электрическую, необходимую для питания Вашего автомобиля, обеспечения напряжением стартера и множества других электрических узлов машины, а также электрическую — обратно в химическую. Ещё одна важная функция аккумулятора — он обеспечивает постоянство силы тока — он также стабилизирует напряжение для того, чтобы двигатель работал.
По-простому принцип работы аккумулятора можно охарактеризовать так: химические процессы в нём приводят в появлению электрического тока, которым питается автомобиль — особенно полезен такой ток, и больше всего его потребляется, когда Вы стартером раскручиваете двигатель, заводя его; когда же автомобиль заведён, то двигатель крутит генератор — и здесь мы видим процесс превращения механической энергии (кручение генератора) в электрическую — в свою очередь генератор передаёт произведённый им ток аккумулятору, и тот превращает уже электроэнергию в химическую — аккумулирует её, сохраняет, чтобы затем опять «накормить» ей тот стартер или любые иные электрические системы автомобиля, когда генератор не работает или же когда электроэнергии, производимой генератором недостаточно для обеспечения всех систем автомобиля.
Автомобильный аккумулятор имеет два полюса: один положительный и второй — отрицательный, и Вы, наверное, уже знаете это, если хотя бы раз видели или отсоединяли/крепили клеммы аккумулятора. Эти полюсы подключаются к машине и отвечают за питание ряда очень важных механизмов автомобиля, в том числе:
- Запуск двигателя
- Кондиционер
- Воспроизведение аудиосистемы
- Все световые механизмы (фары, задние фонари, разного рода подсветки и т.п.)
- Стеклоочистители
- Многое-многое другое.
В подавляющем большинстве случаев аккумулятор состоит из шести ячеек. В каждую ячейку помещаются два электрода, представляющих собой и изготовленных из восьми перекрывающихся металлических пластин. Эти восемь перекрывающихся металлических пластин образуют то, что известно как «гальванический элемент». Таким образом, в общей сложности каждая ячейка включает 2 электрода и 16 пластин. Именно через эти пластина производится питание электричеством автомобиля. Но как это работает?
На самом деле, всё достаточно просто — давайте резюмируем вышеописанное:
- Батарея состоит из шести ячеек
- Каждая ячейка состоит из двух наборов пластин
- Каждый набор пластин включает в себя восемь перекрывающихся металлических пластин
А теперь немного химии…
Первый набор пластин в ячейке является положительным, а второй — отрицательным. Положительное сетка покрыта оксидом свинца и приносит электроны в ячейку. Отрицательный набор покрыт непосредственно свинцом, и он, наоборот, освобождает электроны. Металлические пластины — помните, восемь из них в каждой сетке, 16 в каждой ячейке — находятся в смеси воды и серной кислоты (на самом деле в этой концентрации только около 35 процентов серной кислоты, но этого более чем достаточно, чтобы, например, прожечь одежду и сильно обжечь кожу. Эта смесь действует как электролит — вещество, которое хорошо проводит электричество.
Когда аккумулятор заряжается (от генератора или другими способами), то происходит химическая реакция окисления свинца на положительном заряде, в результате чего электролит насыщается серной кислотой и удельный вес электролита повышается. Когда же аккумулятор, наоборот, разряжается, питая какие-либо электросистемы автомобиля (мы помним, что основной потребитель — это стартер), то за счёт восстановления свинца на другом — отрицательном наборе пластин, в результате которого образуется больше воды, и, следовательно, удельный вес электролита уменьшается. При этом, химический процесс в каждой из пластин настолько ничтожен, что выделяется очень мало энергии, но на выходе из аккумулятора легкового автомобиля, когда все эти реакции проходят по всем 6 ячейкам, мы и получаем уже сокровенные 12 Вольт.
Возможные неполадки аккумулятора
Аккумулятор со временем приходит в негодность — это естественный его износ и, кроме того, разного рода вредные процессы в нём и воздействия на него могут значительно укоротить срок его жизни. И первыми симптомами того, что в аккумуляторе есть неполадки, являются неспособность завести автомобиль (особенно, в морозную погоду).
Итак, какие же могут быть проблемы с аккумулятором?
- Низкий уровень жидкости в аккумуляторе: автомобильные аккумуляторы обычно имеют небольшую часть корпуса в виде полупрозрачной полосы — чтобы Вы всегда могли следить за уровнем жидкости Вашего аккумулятора. Если уровень жидкости ниже свинцовых пластин (проводник электричества) внутри аккумулятора, то это самое время, чтобы либо долить её, либо заменить аккумулятор.
- «Отёк» аккумулятора — это когда корпус Вашего аккумулятора выглядит так, как-будто он съел очень много и вздулся. Это может указывать на срочную замену аккумулятора. Можно обвинить избыточное количества тепла в качестве причины вздутия аккумулятор и, как следствие, уменьшения срока службы аккумулятора.
- Запах тухлых яиц от аккумулятора: Вы можете заметить острый запах тухлого яйца (на самом деле, это запах серы) вокруг своей батареи. Причина: протечка аккумулятора. Протечка эта, кроме запаха, также вызывает коррозию вокруг клемм.
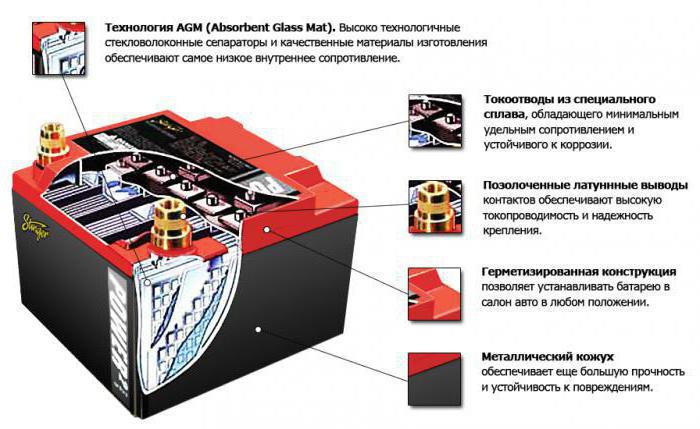
Что такое и как работает аккумулятор с технологией AGM?
В начале 70-х годов прошлого столетия в аккумуляторной среде произошёл настоящий прорыв. Мало того что инженеры научились по максимуму использовать кислотные батареи, так они ещё и придумали инновационные виды аккумуляторов, работающие на электролите-геле. На сегодняшний день именно последние являются наиболее перспективными в плане развития, поэтому мы решили осветить их более детально. Если быть точнее, то в сегодняшнем материале речь пойдёт о подвиде гелевых батарей – AGM аккумуляторах. Не слышали о таких или хотите узнать побольше? Обязательно ознакомьтесь со следующим материалом.
История возникновения
AGM – это аббревиатура, которая расшифровывается как Absorbed Glass Mat, что дословно в переводе с английского означает «абсорбированные стеклянные пластины» или «абсорбированное стекловолокно». Это значит, что внутри нет жидкого электролита, а вместо него находится пропитанное стекловолокно. Технология была запатентована в 1980 году. Но сама идея создания появилась гораздо раньше в послевоенные годы в Германии. Одному фотографу пришла мысль загустить электролит в аккумуляторе, чтобы он не проливался.
AGM аккумулятор
Как и многие другие инновации, AGM аккумуляторы сначала применялись на военных самолетах. Такие АКБ как нельзя лучше подходили для них, так как могли эксплуатироваться в любом положении. И по сей день они применяются на истребителях F16.
