Электролит состав – Электролит Кислотный Для Аккумулятора, Состав и Плотность, Корректирующий Раствор Для Свинцового АКБ, Зарядка Батареи, Изготовление Своими Руками
- 14.04.2020
Щелочной электролит для аккумулятора
Щелочной электролит имеет большое количество преимуществ перед другими видами токопроводящих веществ, поэтому широко используется в современных перезаряжаемых источниках питания. Об основных характеристиках, а также о свойствах и химическом составе этого вещества будет подробно рассказано далее.
Что такое щелочной электролит
Щелочной электролит представляет собой химическое соединение, принимающее активное участие при накоплении аккумулятором электроэнергии. Благодаря определённым свойствам такое вещество может многократно участвовать в восстановительно-окислительных реакциях без потери качества.
В щелочных аккумуляторах используются различные химические составы, поэтому аккумуляторы этого типа могут существенно отличаться по многим показателям.
Свойства и химический состав
Наиболее часто в аккумуляторах применяются щелочные электролиты следующих составов:
- Калиево литиевый.
- Натриевый.
- Никель-кадмиевые.
- Никель-металлогидридные.
Натриевые электролиты обладают большим сроком эксплуатации, но совершенно непригодны для использования при отрицательной температуре воздуха.
Калиево-литиевые в этом отношении значительно превосходят натриево-литиевые составы по морозостойкости, но для работы в тропических условиях не подходят из-за ограничения максимальной эксплуатационной температуры на отметке 35˚С.

применяются в современной электронике, но наличие эффекта памяти налагает на использование таких изделий определённые ограничения.
лишены этого недостатка, но их стоимость довольно велика, что является серьёзным препятствием на пути широкого применения элементов этого типа в качестве портативных источников электроэнергии.
Области применения
Они могут использоваться для заправки аккумуляторных батарей различной ёмкости и вольтажа. Такие изделия широко используются в следующих областях:
- Системы сигнализации.
- В качестве стартерных батарей для военной техники.
- Резервные источники питания для пассажирских вагонов, троллейбусов и трамваев.
- В качестве тяговых устройств для мощных электроустановок.
Компактные батареи с щелочным электролитом могут применяться также в электроинструменте, различных гаджетах и детских игрушках.
Кроме применения в аккумуляторных батареях щелочной электролит может быть использован для меднения стали. Такой метод является одним из самых эффективных для покрытия медью других металлов.
Аналогичные щелочные смеси можно сделать для цинкования. Наиболее часто таким образом покрываются цинком изделия, имеющие сложные геометрические формы.
Как заправлять аккумуляторы
Если восстановить работоспособность аккумулятора с помощью зарядки не удаётся, то возможно потребуется замена щелочного электролита. От правильного выполнения такой работы будет зависеть продолжительность эксплуатации АКБ. Рекомендуется осуществлять замену жидкости в такой последовательности:
- Отсоединить аккумулятор от потребителей электроэнергии.
- Надеть защитные очки и перчатки. Не лишним будет защитить одежду от едкого вещества с помощью прорезиненного фартука.
- Удалить пробки и вылить старую жидкость из банок.
- Произвести подготовку нового электролита.
- Залить до рекомендуемого заводом-изготовителем аккумулятора уровня.
- Установить на место пробки.
- Подключить аккумулятор к зарядному устройству.

Если причина неработоспособности аккумулятора заключалась в некачественном электролите, то после замены химического состава и полной зарядки, АКБ можно будет использовать в стандартном режиме.
Меры предосторожности
Как уже было сказано выше использование перчаток и очков является обязательным условием при выполнении работ с щелочными растворами. Игнорирование этого правила может привести к очень серьёзным последствиям. Например, можно получить серьёзные ожоги слизистой оболочки глаз или повредить кожные покровы верхних конечностей.
Если в результате выполнения работ попадания едкого вещества на кожу не удалось избежать, то поражённые участки следует немедленно промыть большим количеством воды, с добавлением уксуса или лимонной кислоты. Про попадании электролита в глаза также необходимо промыть поражённый орган зрения и немедленно обратиться за медицинской помощью.
При работе с элетролитом и зарядке батареи не рекомендуется курить или разводить открытый огонь в помещении. Несоблюдение этого требования может закончиться взрывом горючего газа, который может образоваться в процессе протекания химических реакций.
Как приготовить щелочной электролит
Его можно приобрести в специализированных магазинах, но если такой возможности нет, то жидкую смесь для заливки в аккумулятор можно приготовить своими руками. Для

выполнения этой работы следует подготовить твёрдую щёлочь, дистиллированную воду и неметаллическую посуду. Приготавливается натриево или калиево-литиевый электролит в такой последовательности:
- Налить в посуду необходимое количество воды.
- В воду аккуратно всыпать заранее приготовленную порцию щёлочи.
- Медленно перемешать стеклянной или пластмассовой лопаткой смесь.
- Произвести замер плотности электролита. Если этот параметр находится на слишком низком уровне, то следует добавить сухое вещество, если слишком высокий, то добавить воды (оптимальное значение 1,2 г/мм3).
- Накрыть посуду крышкой и дать отстояться раствору в течение 3 часов.
- Аккуратно слить разбавленную щелочь таким образом, чтобы осадок остался на дне ёмкости.
Приготовленный раствор следует хранить в стеклянной таре с плотно закупоренными горлышками. В качестве крышек рекомендуется использовать резиновые заглушки либо любой материал, не реагирующий на щёлочь.
При приготовлении электролита также следует соблюдать осторожность и использовать защитные очки и перчатки.
Остались вопросы или есть что добавить? Тогда напишите нам об этом в комментариях, это позволит сделает материал более полным и точным.
Электролиты: свойства и классификации

Растворение кристалла поваренной соли
Как протекает электролитическая диссоциация
Вещества-электролиты устроены за счет ионных или ковалентных полярных связей.

Во время растворения происходит химическое воздействие вещества с молекулами воды, в результате чего оно распадается на электроны. Молекулы воды – активные диполи с двумя полюсами: положительным и отрицательным. Атомы водорода располагаются под углом 104,5°, за счет этого молекула воды приобретает угловую форму.

Вещества, имеющие ионную кристаллическую решетку, намного легче диссоциируют, они уже состоят из активных ионов, а диполи воды во время растворения только ориентируют их. Между диполями воды и ионами электролита возникают усилия взаимного притяжения, связи кристаллической решетки ослабевают и ионы покидают кристалл.

Последовательность процессов при диссоциации растворов с ионной связью
На первом этапе молекулы вещества ориентируются около диполей воды, далее происходит гидратация, а на завершающем этапе диссоциация.
Похожим образом диссоциируют электролиты, у которых молекулы строятся за счет ковалентных связей. Разница только в том, что диполи воды превращают ковалентные связи в ионные. При этом наблюдается такая последовательность процессов:

Электролитическая диссоциация полярной молекулы хлороводорода на гидратированные ионы
В растворах происходит хаотическое движение гидратированных ионов, они могут сталкиваться между собой и опять образовывать отдельные связи. Такой процесс называется ассоциацией.
Классификация электролитов
Все электролиты кроме ионов содержат молекулярные структуры, неспособные переносить разряд. Процентное содержание этих элементов оказывает прямое влияние на возможность проводить ток, параметр обозначается α и определяется по формуле:

Для вычисления берется отношение количества частиц, распавшихся на ионы к общему числу растворенных частиц. Степень распада определяется опытным путем, если она равняется нулю, то диссоциация полностью отсутствует, если равняется единице, то все вещества в электролите распались на ионы. С учетом химического состава электролиты имеют неодинаковую степень диссоциации, параметр зависит от природы и концентрации раствора, чем ниже концентрация, тем выше диссоциация. Согласно данным определениям все электролиты делятся на две группы.
- Слабые электролиты. Имеют очень незначительную степень диссоциации, химические элементы почти не распадаются на ионы. К таким электролитам относится большинство неорганических и некоторые органические кислоты. Слабые электролиты расщепляются на ионы обратимо, процессы диссоциации и ассоциации по интенсивности могут сравниваться, раствор очень плохо проводит электрический ток.

Способность к диссоциации зависит от нескольких факторов, слабые электролиты во многом определяются химическими и физическими особенностями вещества. Важное значение имеет химический состав растворителя.
- Сильные электролиты. Эти растворы в водных растворах интенсивно диссоциируют на ионы, сильные электролиты могут иметь степень диссоциации равную единице. К ним относятся почти весь перечень солей и многие кислоты неорганического происхождения. Сильные электролиты диссоциируют необратимо:

От каких факторов зависит степень диссоциации
- Природа растворителя. Степень диссоциации веществ увеличивается прямо пропорционально полярности. Чем больше полярность, тем выше активность имеют сильные электролиты.
- Температура во время подготовки раствора. Повышение температуры растворителя увеличивает активность ионов и их количество. Правда, при этом есть вероятность одновременного повышения ассимиляции. Процесс растворения веществ в растворителе должен непрерывно контролироваться, при обнаружении отклонений от заданных параметров немедленно вносятся корректировки.
- Концентрация химических веществ. Чем выше концентрация, тем больше вероятность, что после растворения образуются слабые электролиты.

График зависимости константы диссоциации от концентрации
Главные положения теории электролитической диссоциацииСогласно существующей теории, электролитическая диссоциация позволяет растворам проводить электрический ток. В зависимости от этой способности они делятся на электролиты и неэлектролиты. Процесс распада веществ на ионы называется диссоциацией, положительно заряженные двигаются к катоду и называются катионами, негативно заряженные двигаются к аноду и называются анионами. Состав электролитов оказывает влияние на способность к диссоциации, технические нормы позволяют определять эту зависимость количественно.
С учетом получаемых после диссоциации ионов изменяется свойство электролитов. Вне зависимости от химического характера образуемых после диссоциации ионов, электролиты подразделяются на три большие классы:
1.Кислоты. В результате распада образуются анионы кислотного остатка и катионы водорода. Кислоты многоосновные могут преобразовываться по первой степени:

2. Основания. Электролиты, дисоциирующие на анионы гидроксогрупп и катионы металла.

3. Соли. Электролиты диссоциируют на анионы кислотного остатка и катионы металлов. Процесс происходит в одну ступень.

Химические свойства электролитов описываются при помощи химических уравнений и определяются свойствами образованных ионов. Для удаления вредных химических соединений, выделяемых в воздух во время диссоциации, используются химически нейтральные пластиковые воздуховоды.
Перспективы развития теории диссоциацииНа современном этапе развития теории ученые предпринимают попытки описать динамические и термодинамические свойства электролитов учитывая концепцию ионно-молекулярной структуры. Классическая теория считается примитивной, в ней ионы представляются как заряженные жесткие сферы. Главный недостаток традиционной теории – невозможность объяснить локальное снижение диэлектрической проницательности в первом приближении. Ряд растворителей поддается описанию физических свойств ступенчатой зависимостью, но протонные водные растворители имеют намного сложнее процессы релаксации.
Непримитивные модели, рассматривающие ионы в одинаковом масштабе, делятся на две группы:
- Первая. Жидкие фазы рассматриваются как максимально разупорядочные кристаллы, размеры не более пяти молекулярных диаметров.
- Вторая. Жидкости описываются как сильно неидеальные газы. Молекулы растворителя являются точными или обыкновенными диполями.
Зависимость диэлектрической проницаемости от расстояния между ионами

Неравновесные явления в растворах электролитов
Неравновесный распад объясняется несколькими физическими процессами.
- Миграцией и диффузией ионов. Обуславливается сравнительно большим количеством ионных перескоков за единицу времени в сравнении с иными направлениями.
Контакт двух растворов с различными показателями концентрации

- Эквивалентной и удельной электропроводностью. Электропроводность обеспечивается миграцией ионов, замеры выполняются таким способом, чтобы исключалось влияние градиента химического потенциала.
Принципиальная схема моста переменного тока во время измерения электропроводности

- Числом переноса. Определяется суммой электрической проворности аниона и катиона. Доля тока называется электрическим числом переноса.
Схема определения числа переноса

Перемещение ионов в среде электрического поля по статистике является усредненным процессом, ионы делают беспорядочные перескоки, а элегическое поле оказывает только определенное влияние, точно рассчитать силу и вероятность влияния невозможно. В связи с этим, аналогия диссоциации с обыкновенным поступательным движением твердых тел весьма приближенная, но она позволяет принимать правильные качественные выводы.
области применения, срок службы АКБ и подробная характеристика
 Очень популярный вид энергетического накопителя — щелочные аккумуляторы — это объясняется их многофункциональностью. В качестве электролита используется едкий натрий или калий. Перед тем как покупать подобное оборудование, потребуется ознакомиться со всеми положительными и отрицательными сторонами, а также особенностями аппарата.
Очень популярный вид энергетического накопителя — щелочные аккумуляторы — это объясняется их многофункциональностью. В качестве электролита используется едкий натрий или калий. Перед тем как покупать подобное оборудование, потребуется ознакомиться со всеми положительными и отрицательными сторонами, а также особенностями аппарата.
Конструктивные особенности
Аккумулятор состоит из гидроокиси никеля, а также некоторых иных элементов. Из-за того, что в составе имеется графит, это оказывает положительное влияние на электрическую проводимость. Различные примеси осуществляют нормальную работоспособность и стабильность аппарата.
Чтобы подготовить отрицательный элемент, используют металлический сплав кадмия, никеля и определённого порошка. В каждом случае АКБ будет иметь свои особенности. Электролит включает в себя моногидрат лития. Благодаря этому элементу обеспечивается долгая деятельность агрегата.
В состав батареи входят следующие компоненты:
 Изоляционный слой, изготовленный из качественного сырья.
Изоляционный слой, изготовленный из качественного сырья.- Прокладка из пластика, которая дополняется специальным клапаном.
- Корпус.
- Выводы и контакты.
Это все основные элементы щелочного аккумулятора. Все компоненты выполнены из надёжных материалов, а потому проблем с работой не возникает.
Химические процессы
Принцип работы очень простой. Когда происходит полная разрядка, гидроокись никеля начинает взаимодействовать с щелочным раствором. В результате образовывается гидрат закиси никеля. На выводе с минусом будет происходить очень похожий процесс. Начинают формироваться определённые элементы.
 Когда идёт процесс зарядки, проходит обратная реакция. В результате получится гидроокись никеля, которая восстанавливает минусовый электрод.
Когда идёт процесс зарядки, проходит обратная реакция. В результате получится гидроокись никеля, которая восстанавливает минусовый электрод.
От кислотных агрегатов щелочный отличается тем, что субстанция, выработанная в ходе химической реакции, не будет растворяться. Она также не в состоянии реагировать с похожими компонентами. Если говорить проще — принцип действия источника питания зависит от определённых канонов.
Этот источник питания необходимо полностью заряжать. Если произойдёт неполный заряд батареи, то период использования сильно сократится. Но при этом нельзя перезаряжать устройство, поскольку это приведёт к сильному перегреву. В результате электроды просто разрушатся.
Замена электролита
Замену электролита необходимо производить через 100 и 150 циклов. До смены потребуется полностью разрядить АКБ и проследить, чтобы номинальный ток составлял до 1 В.

Электролит нужно предельно тщательно удалять из батареи. Чтобы осадок не остался, необходимо встряхнуть аккумулятор во время чистки.
После того, как электролит будет вылит, нужно хорошо промыть агрегат дистиллированной водой. А также можно применять раствор из щёлочи.
Когда процесс очистки завершится, можно сразу же залить новый электролит. После его потребуется оставить в залитом состоянии примерно на 3 часа. Только тогда можно проверить плотность нового вещества.
Следует знать, что электроды и пластины не должны находиться в сухом состоянии. Если пренебрегать этим правилом, то внутри появится коррозия.
Преимущества и недостатки
Перед покупкой следует изучить все плюсы и минусы аппарата. Это убережёт человека от неправильной покупки в том случае, если минусы перевесят положительные стороны для него.
Начать лучше с преимуществ:
- Если производить своевременное техническое обслуживание и правильно использовать аккумулятор, тогда срок службы щелочных аккумуляторов можно сильно увеличить.
- Аппарат нормально реагирует на глубокий разряд.
- Работоспособность будет сохраняться даже в условиях отрицательных температур.
- Минимальная величина саморазряда. Но необходимо подобрать правильное зарядное устройство.
- Вес устройства — небольшой.
К положительным качествам также относится то, что при отрицательных температурах показатель ёмкости снизится минимально. Кислотные агрегаты отличаются от щелочных тем, что первые будут терять свою ёмкость. Несмотря на много положительных сторон, имеются и отрицательные:
- У аппарата есть эффект памяти. В результате это может спровоцировать снижение ёмкости. Именно поэтому следует полностью заряжать аккумулятор и не допускать недозарядку.
- Рабочие напряжения элементов будут отличаться друг от друга. Именно поэтому необходимо применять эффективно агрегат для зарядки.
- Не слишком большой КПД.
- Электролит желательно не заменять самостоятельно, а доверить эту операцию специалисту.
Это были основные достоинства и недостатки щелочного аппарата. В большинстве случаев плюсы перевешивают минусы.

Отрасли использования
Щелочные агрегаты применяются в разных сферах. Щелочные аккумуляторы применяются в:
- Системах энергосбережения.
- Различных технических и электрических устройствах.
- Пассажирских вагонах.
- Электроинструменте.
- Портативных техсредствах.
В разных сферах применяют различные модели щелочных аккумуляторов. А также АКБ часто используют на автотранспортных средствах, специальной технике и различных погрузчиках. Для простых легковых автомобилей этот агрегат используется редко.

Правила эксплуатации
Чтобы АКБ прослужил долго, необходимо использовать определённые правила. Для правильной эксплуатации существует конкретный ряд действий:
- Перед запуском в работу необходимо увеличить ёмкость до определённого значения. С этой целью используют 1 тренировку.
- Корпус желательно часто очищать от грязи, соли и пыли.
- Чтобы удалить коррозию, используют ветошь, которая смачивается в керосине.
- Если используется соединение нескольких батарей, необходимо, чтобы соединение было очень плотным.
- Уровень электролита желательно часто проверять. Он должен быть в пределах 4−12 мм.
Если аккумулятор долго не используется, необходимо его периодически подзаряжать в нормальном режиме. Сила тока будет регулироваться от внешнего источника.
Разряд и заряд
Чтобы правильно зарядить аккумулятор из щёлочи, необходимо использовать постоянный ток. Автомобилисты обычно используют автоматическое зарядное устройство. Чтобы правильно зарядить батарею, необходимо учитывать некоторые режимы:
- Стандартный — 7 часов.
- Ускоренный — 3 часа.
- Усиленный — 12 часов.
Усиленный режим допускается, если аккумуляторная батарея заряжается в первый раз, используется нерегулярно, или только что произошла перезарядка электролита. А также такой режим используют после того, как АКБ была полностью разряжена.

При малом токе аккумулятор заряжаться будет очень плохо. Ток не рекомендуется понижать на 40 или 50%. Если батарея частично или полностью разряжена, то ни в коем случае нельзя допускать перегрева. Электролит начинает закипать при 35 градусах. Иные части — при 45 градусах. Когда достигается критическая температура, необходимо сразу же отключить источник питания от сети. Продолжить зарядку можно, когда температура станет оптимальной.
Аккумулятор на 12 вольт запрещено заряжать при отрицательных температурах на улице. Если нет иного варианта, то батарею потребуется дополнительно утеплить. Обычно для этого используют брезент — обматывают им батарею.
Если используется последовательное подключение нескольких батарей, то их необходимо держать на определённом расстоянии друг от друга. Таким образом обеспечивается сохранение корпуса устройства. Если поставить их слишком близко, то они начнут вздуваться. Чтобы разделить источники питания, обычно используют виниловые пластины и обычную резину.
Чтобы правильно произвести разрядку аккумуляторной батареи, нужно делать это до определённых значений:
 Если разряд длится 5 часов, напряжение не должно превышать 1 Вольт.
Если разряд длится 5 часов, напряжение не должно превышать 1 Вольт.- Три часа — 0,8 Вольт.
- 1 час — 0,5 Вольт.
Чтобы отследить уровень напряжения, можно использовать тестировочный аппарат. Контрольные испытания делают после полной замены электролита. Перед этим нужно использовать несколько проверочных циклов. После полной зарядки напряжение составляет 1,1 Вольт. Когда проводится контрольный цикл, необходимо произвести замеры напряжения при разряженном устройстве.
Сокращение периода эксплуатации
Чтобы продлить срок эксплуатации АКБ, надо придерживаться основных правил. Они довольно простые, но эффективно позволяют справиться с поставленной задачей:
- Нельзя допускать постоянной недозарядки батареи.
- До критического значения опускать показания напряжения не следует.
- Вещество внутри АКБ должно покрывать пластины. Плотность электролита необходимо менять, когда наблюдается повышение температуры.
Правила — простые. Их легко соблюдать, чтобы продлить срок эксплуатации.
Нюансы маркировки
В маркировку аккумуляторной батареи входят цифры и буквы. Легко узнать отрасли использования, если смотреть на буквы:
- Т обозначает агрегат для тяговых моделей.
- ТП — тепловозные аккумуляторы.
- В — вагонный.
Также в маркировку могут включаться и другие буквы. О них также необходимо знать, чтобы производить правильно расшифровку:
 НЖ — никелево-железный агрегат.
НЖ — никелево-железный агрегат.- К — присутствие блока, предназначавшегося для нескольких электродов.
- Ш — эксплуатация в рудниках.
- П обозначает, что корпус изготовлен из пластичного материала.
- М — модернизированный вариант.
- У означает, что агрегат можно использовать в умеренном климате.
- Т — тропический климат.
Щелочные батареи — многофункциональные. Они могут включать в себя различные сочетания. Самыми распространёнными моделями являются на 12 В.
Правила хранения
Устройства бывают длительного или временного хранения. Когда приобретается новая АКБ, обязательно надо проверить пробки — их прилегание.
Очень большое внимание необходимо уделить проверке вентильной резины. От её состояния будет зависеть работа всей батареи. Чтобы лакокрасочный состав не слезал, надо корпус обрабатывать смазкой.
Для правильного хранения потребуется выполнять ряд действий:
 Произвести разрядку до 1 вольта.
Произвести разрядку до 1 вольта.- Вылить весь электролит.
- Удалить пыль, грязь и соль.
- Обновить лаковое покрытие.
Если аккумулятор будет находиться в состоянии покоя 1−10 месяцев, необходимо периодически проверять его работоспособность. Все пробки должны быть плотно прижатыми к устройству. Транспортировку можно производить только в том случае, если батарея подготовлена к длительному хранению. С другими источниками питания нежелательно хранить щелочные АКБ.
Особенности выбора
Чтобы правильно подобрать щелочную аккумуляторную батарею, надо особое внимание уделять ключевым параметрам. Они крайне важны для правильной покупки:
- В первую очередь смотрим на производство. Всегда нужно изучить дату изготовления. Если АКБ была произведена больше полугода назад, тогда приобретать её не стоит. Такие устройства будут разряжаться — эффект памяти это зафиксирует.
- Показатель ёмкости. Срок применения зависит от ёмкости. Многие приобретают АКБ с большой ёмкостью. В таком случае генератор не сможет справиться со своей задачей. Но и меньше ёмкость приобретать не стоит. Много зарядов способствуют поломке всего агрегата. Чтобы подобрать правильную ёмкость, необходимо изучить определённые характеристики, указанные в технической эксплуатации.
- Полярность устройства. АКБ могут различаться по степени полярности. Когда идёт выбор агрегата, потребуется сосредоточиться на расположении полярности электродов.
- Стоимость батареи. Цена АКБ зависит от элементов, которые входят в состав, изготовителя, ёмкости, мощности. Чем лучше показатели, тем выше цена.
Щелочный агрегат отличается прочностью и надёжностью. Очень выгодно приобретать такие средства для тяговой техники или габаритных автотранспортных средств. Необходимо только правильно выбрать модель, изучив предварительно все характеристики.
Это была краткая характеристика и применение щелочных аккумуляторов. Сведения пригодятся для верной эксплуатации и правильной покупки.
Состав электролитов железнения и его режимы

Осаждение железа ведут в ваннах, изготовленных из листовой стали, с пароводяной рубашкой, аналогично ваннам хромирования, но футеровку внутренней поверхности производить антег-митовыми плитками.
Существующие электролиты для железнения подразделяются на:
- хлористые;
- сернокислые;
- смешанные.
Кроме того, могут применяться борфтористоводородные, сульфаматные и прочие электролиты с различными добавками для повышения блеска, твердости и получения специальных свойств.
По способу применения процессы железнения подразделяют на холодные и горячие. В холодных электролитах (20-50 °С) процесс железнения проводят при малой плотности тока. Скорость осаждения металла в этих электролитах не превышает 100-130 мкм/ч. В горячих электролитах, нагретых до 50-105 °С, электролиз протекает при высоких плотностях тока (1020 А/дм2), скорость отложения металла значительно повышается.
Резкие колебания температуры при железнении в горячих электролитах могут вызвать колебания напряжений по толщине слоя осадков. Поэтому возможно растрескивание и отслаивание покрытия. При наращивании деталей нельзя допускать колебаний температуры более ±2 °С. Колебания плотности тока в меньшей степени влияют на изменение свойств покрытия, чем температура. Однако желательно, чтобы не было и значительных колебаний плотности тока.
При осаждении электролитического железа необходимо избегать выключения тока. При длительной работе с перерывами тока следует перед каждым продолжением осаждения проводить анодную обработку детали в том же электролите в течение 1-2 мин при плотности тока 30-40 А/дм2.
Процесс покрытия электролитическим железом осуществляют с использованием растворимых (стальных) и нерастворимых (угольных) электродов. При наращивании слоя покрытия с помощью нерастворимых электродов необходимо систематическое корректирование состава электролита по мере истощения раствора.
Хлористые электролиты
Наибольшее применение получили хлористые электролиты, отличающиеся высокой концентрацией солей, большой скоростью наращивания железа и возможностью получения покрытий с большой толщиной. Эти электролиты получили применение на авторемонтных и других заводах для восстановления размеров на деталях, получивших большой износ.
Основным компонентом хлористого электродита для железнения является хлористое железо. Хлористое железо FeCl2*4Н2О — светло-зеленые кристаллы, растворимость — свыше 600 г/л при 20 °С, молекулярная масса 198,9. При нагревании растворимость еще более возрастает. Соль легко подвергается гидролизу, и ее растворы всегда следует подкислять соляной кислотой в количествах до 0,5-0,7 г/л. При высокой концентрации хлористого железа в хлористом электролите, состоящем в основном лишь из хлористого железа, концентрацию его растворов легко определить по плотности.
Для горячих хлористых электролитов разработано много вариантов с введением в их состав хлористого марганца, хлористого никеля, гипофосфита натрия и других солей. Составы и режимы осаждения железа приведены в табл. 5.3.
Электролит должен быть прозрачным, иметь зеленый цвет. Фильтровать его следует не реже одного раза в 10-15 сут при работе в две смены.
Твердость полученного слоя железа определяется температурой электролита и может изменяться от 100 до 400 НВ. В хлористых электролитах твердость осажденного железа возрастает с уменьшением концентрации хлористого железа и соляной кислоты, а также при увеличении катодной плотности тока и понижении температуры электролита.
Температура электролита оказывает наиболее существенное влияние на твердость осажденного покрытия. Так, в хлористом электролите (400 г/л FeCl2, 10 г/л NaCl и 1 г/л НСl) при понижении его температуры всего на 10 °С твердость осадка повышается на 40-60 единиц. При дальнейшем снижении температуры до 75 °С твердость повышается до 300 НВ. При регулировании твердости покрытия за счет температуры электролита следует учитывать, что чрезмерное понижение температуры приводит к растрескиванию и скалыванию наращенного слоя.
Таблица 5.3. Составы хлористых электролитов и режимы железнения.
|
Компоненты электролита и режимы процесса |
Составы электролита, г/л |
|||
|
1 |
2 |
3 |
4 |
|
|
Хлористое железо |
200-250 |
300-350 |
600-680 |
200-300 |
|
Хлористый марганец |
— |
— |
— |
20-30 |
|
Хлористый натрий |
100 |
— |
— |
— |
|
Соляная кислота |
— |
— |
— |
0,5-1,0 |
|
Кислотность рН |
0,8-1,2 |
0,8-1,2 |
0,8-1,5 |
— |
|
Температура электролита, °С |
70-80 |
70-80 |
70-80 |
60-80 |
|
Плотность тока, А/дм2 |
20-40 |
20-50 |
20-60 |
30-50 |
|
Выход по току, % |
85-92 |
85-95 |
85-95 |
90-95 |
Для катодного осадка электролитического железа характерны значительные внутренние напряжения. При железнении в хлористых электролитах при температуре 95 °С и плотности тока 5 А/дм2 остаточные напряжения в осажденном железе составляют примерно 150 МПа. При увеличении плотности тока до 20 А/дм2 напряжения возрастают до 370 МПа. Отпуск деталей, покрытых электролитическим железом, при температуре 500-600 °С уменьшает остаточные напряжения на 15-20 %. В электролитическом железе, полученном из хлористых электролитов при температуре 100 °С, содержится лишь 0,002-0,003 % водорода.
Сернокислые электролиты
При осаждении в сернокислых электролитах получают более хрупкие и крупнокристаллические осадки, чем в хлористых. Пластичные осадки железа в сернокислых ваннах образуются при нормальной температуре и низких плотностях тока (0,1-0,2 А/дм2). Электролитическое железо, осажденное из сернокислых растворов при 18 °С, содержит 0,085 % водорода, а твердость — 200-300 НВ.
Из сернокислых электролитов, применяемых на практике, наибольшее распространение получили растворы, в которых процесс производится без нагрева электролита или при небольшом повышении температуры. Для них также необходима анодная обработка деталей перед покрытием, как это указано при осаждении железа из хлористых электролитов (табл. 5.4).
Сернокислые и хлористые электролиты при повышенной температуре агрессивны к металлам оснастки ванны.
Процесс наращивания элемента детали железом, упрощается при применении борфтористоводородных электролитов следующего состава (г/л) и режимов:
борфтористоводородное железо — 300; борная кислота — 18;
свободная борфтористоводородная кислота — 1-2; температура, °С — до 20-60; плотность тока, А/дм2 — 2-12; кислотность рН — 3,5.
Таблица 5.4. Составы хлористых электролитов и режимы железнения.
|
Компоненты электролита и режимы процесса |
Составы электролита, г/л |
||
|
1 |
2 |
3 |
|
|
Сернокислое железо |
180-200 |
3150 |
200-450 |
|
Сернокислый магний |
40-50 |
— |
— |
|
Сернокислый натрий |
— |
100 |
— |
|
Двууглекислый натрий |
25-30 |
— |
— |
|
Серная кислота |
— |
1 |
— |
|
Борная кислота |
— |
— |
10-20 |
|
Борфтористоводородный калий |
— |
— |
20-35 |
|
Кислотность рН |
— |
2,4-2,5 |
1,9-2,4 |
|
Температура электролита, °С |
18-20 |
60-70 |
18-25 |
|
Плотность тока, А/дм2 |
0,1-0,15 |
5-10 |
До 7,0 |
|
Выход по току, % |
— |
— |
70-95 |
Таблица 5.5. Скорость осаждения железа при различных значениях плотности тока и выхода по току.
|
Плотность тока, А/дм2 |
Катодный выход по току, % |
|||
|
90 |
92 |
94 |
95 |
|
|
1 |
12,0 |
12,3 |
12,5 |
12,7 |
|
5 |
60,1 |
61,5 |
62,9 |
63,6 |
|
10 |
120,0 |
123,0 |
125,2 |
126,8 |
|
30 |
360,0 |
369,0 |
375,6 |
380,4 |
|
50 |
601,0 |
615,0 |
629,0 |
635,0 |
Электролит устойчив против окисления и характеризуется хорошей рассеивающей способностью. При наличии перемешивания электролита допускается увеличение плотности тока в 1,2—1,5 раза.
Скорость осаждения железа можно ориентировочно определить по табл. 5.5.
Возможно Вас так же заинтересуют следующие статьи: comments powered by HyperCommentsЭлектролитический конденсатор — Википедия
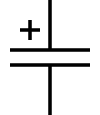 Обозначение на электрических схемах
Обозначение на электрических схемахЭлектролити́ческие конденсаторы — разновидность конденсаторов, в которых диэлектриком между обкладками является плёнка оксида металла, где анод выполнен из металла, а катод представляет собой твёрдый, жидкий или гелевый электролит. Слой оксида на поверхности анода получают методом электрохимического анодирования, что обеспечивает высокую однородность по толщине и диэлектрическим свойствам диэлектрика конденсатора. Технологическая лёгкость получения тонкой однородной плёнки диэлектрика на большой площади электрода позволила наладить массовое производство дешёвых конденсаторов с весьма высокими значениями показателями электрической ёмкости.
Наибольшее распространение получили алюминиевые электролитические конденсаторы (англ.)русск., в которых в качестве одной из обкладок применяется алюминиевая фольга. Также распространены танталовые (англ.)русск. и ниобиевые (англ.)русск. электролитические конденсаторы, в которых металлическим электродом выступает пористая металлическая губка из тантала или ниобия, поверхность которой покрыта оксидными плёнками. Второй обкладкой электролитического конденсатора служит жидкий или твёрдый электролит — вещество или композиция веществ, обеспечивающих электропроводность и сохранение оксидной плёнки.
Электрохимические процессы получения и стабилизации оксидной плёнки диэлектрика требует определённой полярности напряжения на границе металл-электролит. Металлический электрод должен быть анодом (то есть обладать положительным потенциалом), а электролит — катодом (отрицательный потенциал). Несоблюдение полярности вызывает потерю диэлектрических свойств оксидной плёнки и возможное короткое замыкание между обкладками. Если источник этого отрицательного напряжения не ограничивает ток на безопасном низком уровне, то электролит нагреется протекающим током, закипит и давление образующихся газов разорвёт корпус конденсатора. Выпускаются и так называемые неполярные электролитические конденсаторы, в которых конструктивно размещено два встречно-последовательно включённых обычных полярных электролитических конденсатора, которые допускают изменение полярности приложенного напряжения.
Состав электролита подбирается таким образом, чтобы в процессе работы восстанавливались мелкие повреждения в оксидной плёнке электрохимическим анодированием при рабочих напряжениях конденсатора. Однако при этом химическом процессе электролиза выделяется газ, давление которого приводит к вздутию корпуса и даже его возможному разрыву. Также к вскипанию электролита может приводить большой ток через конденсатор, например при обратной полярности включения или при протекании большого реактивного тока при больших пульсациях напряжения на конденсаторе.
Для конденсаторов с жидким электролитом существует проблема высыхания, когда растворитель из электролита испаряется из конденсатора через неплотности герметизации корпуса. При высыхании конденсатор теряет ёмкость и увеличивается последовательное паразитное сопротивление.
Конструкция электролитического конденсатора[править | править код]
Электролитические конденсаторы устроены, как правило, следующим образом: слой электролита заключается между электродами с металлическим типом проводимости, один из которых покрыт тонким слоем диэлектрика (оксидной плёнкой). За счёт чрезвычайно малой толщины диэлектрика, ёмкость конденсатора достигает значительных величин. Однако, соприкосновение двух проводящих пластин, разделённых тонким диэлектриком не является идеальным, для устранения воздушного зазора, в пространство между пластинами вводят электролит.
По типу наполнения электролитом электролитические конденсаторы можно разделить на: жидкостные, сухие, оксидно-полупроводниковые и оксидно-металлические.
В жидкостных конденсаторах используют жидкий электролит, для увеличения ёмкости анод изготавливают объёмно-пористым, например, путём прессования порошка металла и спекания его при высокой температуре. В сухих конденсаторах применяется вязкий электролит. В этом случае конденсатор, изготавливается из двух лент фольги (оксидированной и неоксидированной), между которыми размещается прокладка из бумаги или ткани, пропитанная электролитом.
В оксидно-полупроводниковых конденсаторах в качестве катода используется проводящий оксид (диоксид марганца).
В оксидно-металлических конденсаторах функции катода выполняет металлическая плёнка оксидного слоя.
Изготовляемые промышленностью алюминиевые электролитические конденсаторы состоят из двух тонких алюминиевых пластин фольги. Между пластинами помещается прокладка — пористая бумага, пропитанная электролитом. Фольга и прокладка сворачивается в рулон и помещается в корпус через который сделаны два электрических вывода. Под химическим действием электролита при приложении электрического напряжения поверхность алюминиевой фольги анода окисляется, — на поверхности фольги образуется тонкий слой диэлектрика — оксида алюминия.
При напряжении обратной полярности процесс регенерации диэлектрического слоя прекращается, он постепенно разрушается, приводя к повышенным значениям токов утечки, что может привести к повреждению электрической схемы, причем отказ конденсатора в сильноточных цепях сопровождается выделением тепла, выделением дыма и газов внутри конденсатора, что может привести к разрушению его корпуса. Поэтому электролитические конденсаторы предназначены для работы лишь в цепях с пульсирующим напряжением одной полярности, либо в цепях с постоянным током.
Особенности применения электролитических конденсаторов[править | править код]
 Современные конденсаторы, разрушившиеся без взрыва благодаря специальной разрывающейся конструкции верхней крышки. Конденсаторы со вздувшейся или разорванной крышкой обычно практически непригодны и требуют замены.
Современные конденсаторы, разрушившиеся без взрыва благодаря специальной разрывающейся конструкции верхней крышки. Конденсаторы со вздувшейся или разорванной крышкой обычно практически непригодны и требуют замены.Электролитические конденсаторы (в радиотехнике часто используется жаргонное название — «электролиты») являются низкочастотными элементами электрической цепи, их редко применяют для работы на частотах выше 30 кГц. В основном они служат для сглаживания пульсирующего тока в цепях выпрямителей переменного тока. Например, электролитические конденсаторы широко используются в звуковоспроизводящей и звукоусилительной технике. Межкаскадные в многокаскадных усилителях электролитические конденсаторы разделяют пульсирующий ток (ток звуковой частоты + постоянная составляющая) на переменную составляющую — ток звуковой частоты, который подаётся на следующий каскад усиления и постоянную составляющую, которая не проходит на последующий каскад усиления. Такие конденсаторы называют разделительными.
В связи с тем, что электролитические конденсаторы полярны, при работе на их обкладках должно поддерживаться не изменяющее знака напряжение, что является их некоторым недостатком. Включение конденсатора в электрическую цепь с обратной к рабочей полярностью вызывает увеличение тока утечки, деградации параметров, и даже может привести к взрыву конденсатора при достаточной мощности цепи. По этой причине их можно применять только в цепях, где полярность напряжения на конденсаторе неизменна (с пульсирующим или постоянным напряжением).
Электролитические конденсаторы обладают заметным последовательным паразитным сопротивлением, которое может достигать значения порядка 1 Ом на низких частотах и это сопротивление возрастает с ростом рабочей частоты. Причина этого эффекта — сравнительно низкая проводимость и подвижность ионов электролита. Обычно состав жидкого электролита — водный раствор борнокислого аммония, борной кислоты и этиленгликоля[1].
Широко распространённые алюминиевые конденсаторы по сравнению с другими конденсаторами имеют некоторые специфические свойства, которые следует учитывать при их использовании. За счёт того, что алюминиевые обкладки электролитических конденсаторов скручены в рулон для помещения в цилиндрический корпус, образуется паразитная последовательная индуктивность, эта индуктивность во многих применениях нежелательна.
На верхней части цилиндрического корпуса некоторых электролитических конденсаторов выполнена защитная насечка — предохранительный клапан. Если конденсатор работает в сильноточной цепи переменного напряжения, то он разогревается и жидкий электролит расширяется, испаряется. Корпус конденсатора может лопнуть от избыточного внутреннего давления. Поэтому и применяется защитный клапан, разрушающийся под действием избыточного давления и предотвращающий взрыв корпуса конденсатора с выпуском паров электролита наружу.
Из-за невозможности достичь достаточной герметизации корпуса в некоторых конструкциях электролитических конденсаторов жидкий электролит со временем высыхает. При этом теряется ёмкость конденсатора и увеличивается последовательное сопротивление. Также ускоренному высыханию электролита способствует повышенная температура эксплуатации. Поэтому на корпусе практически любого электролитического конденсатора обычно указывается допустимый диапазон рабочей температуры. Например, от −40 до +105 °C.
Вышедший из строя электролитический конденсатор в результате высыхания электролита в подавляющем числе случаев служит основной причиной отказа бытовой радиоэлектронной аппаратуры[2].
Электролиты: понятие и свойства
Электролиты — растворы, содержащие большую концентрацию ионов, обеспечивающих прохождение электрического тока. Как правило, это водные растворы солей, кислот и щелочей.
Это интересно
В организме человека и животных электролиты играют важную роль: к примеру, электролиты крови с ионами железа транспортируют кислород в ткани; электролиты с ионами калия и натрия регулируют водно-солевой баланс организма, работу кишечника и сердца.
Свойства
Чистая вода, безводные соли, кислоты, щелочи ток не проводят. В растворах же вещества распадаются на ионы и проводят ток. Именно поэтому электролиты называют проводниками второго порядка (в отличие от металлов). Электролитами могут быть также расплавы и некоторые кристаллы, в частности диоксид циркония и иодид серебра.
Главное свойство электролитов — способность к электролитической диссоциации, то есть к распаду молекул при взаимодействии с молекулами воды (или других растворителей) на заряженные ионы.
По типу ионов, образующихся в растворе, различают электролит щелочной (электропроводимость обусловлена ионами металлов и ОН-), солевой и кислотный (с ионами Н+ и остатками основания кислоты).
Для количественной характеристики способности электролита к диссоциации введен параметр «степень диссоциации». Эта величина отражает процент молекул, подвергшихся распаду. Она зависит от:
• самого вещества;
• растворителя;
• концентрации вещества;
• температуры.
Электролиты делят на сильные и слабые. Чем лучше реагент растворяется (распадается на ионы), тем сильнее электролит, тем лучше он проводит ток. К сильным электролитам относятся щелочи, сильные кислоты и растворимые соли.
Для электролитов, использующихся в аккумуляторах, очень важен такой параметр, как плотность. От нее зависят условия эксплуатации аккумулятора, его емкость и срок службы. Определяют плотность с помощью ареометров.
Меры предосторожности при работе с электролитами
Самые популярные электролиты, это раствор концентрированной серной кислоты и щелочи — чаще всего гидроксиды калия, натрия, лития. Все они вызывают химические ожоги кожи и слизистых, очень опасные ожоги глаз. Именно поэтому все работы с такими электролитами нужно производить в отдельном, хорошо вентилируемом помещении, используя средства защиты: одежду, маски, очки, резиновые перчатки.
• Рядом с помещением, где проводятся работы с электролитами, должна храниться аптечка с набором нейтрализующих средств и кран с водой.
• Кислотные ожоги нейтрализуются раствором соды (1 ч.л. на 1 ст. воды).
• Ожоги щелочью нейтрализуют раствором борной кислоты (1 ч.л. на 1 ст. воды).
• Для промывания глаз нейтрализующие растворы должны быть в два раза слабее.
• Поврежденные участки кожи сначала промывают нейтрализатором, а потом мылом и водой.
• Если электролит пролили, его собирают опилками, потом промывают нейтрализатором и вытирают насухо.
При работе с электролитом следует выполнять  все требования техники безопасности. Например, кислоту наливают в воду (а не наоборот!) не вручную, а с помощью приспособлений. Куски твердой щелочи в воду опускают не руками, а щипцами или ложками. Нельзя работать в одном помещении с аккумуляторами на разнотипных электролитах, и хранить их вместе тоже запрещается.
все требования техники безопасности. Например, кислоту наливают в воду (а не наоборот!) не вручную, а с помощью приспособлений. Куски твердой щелочи в воду опускают не руками, а щипцами или ложками. Нельзя работать в одном помещении с аккумуляторами на разнотипных электролитах, и хранить их вместе тоже запрещается.
Некоторые работы требуют «кипения» электролита. При этом выделяется водород — горючий и взрывоопасный газ. В таких помещениях должна использоваться взрывобезопасная электропроводка и электроприборы, запрещается курение и любые работы с открытым огнем.
Хранят электролиты в пластиковых емкостях. Для работы подходит стеклянная, керамическая, фарфоровая посуда и инструменты.
В следующей статье расскажем подробнее о видах и применении электролита.

 Изоляционный слой, изготовленный из качественного сырья.
Изоляционный слой, изготовленный из качественного сырья. Если разряд длится 5 часов, напряжение не должно превышать 1 Вольт.
Если разряд длится 5 часов, напряжение не должно превышать 1 Вольт. НЖ — никелево-железный агрегат.
НЖ — никелево-железный агрегат. Произвести разрядку до 1 вольта.
Произвести разрядку до 1 вольта.