Какой газ выделяет аккумулятор – При зарядке аккумулятор кипит — это нормально или нет? Узнайте, почему при зарядке аккумулятора кипит электролит
- 13.01.2021
Вся правда о кислотных и гелевых аккумуляторных батареях
Перед всеми производителями АКБ стоит основная задача — повысить КПД батарей. Чтобы КПД повысить — необходимо снизить внутреннее сопротивление в батарее. Чем меньше сопротивление, тем быстрее АКБ принимает ток (заряжается) и лучше отдает (разряжается). Для достижения данной цели очень важно в производстве АКБ использовать высококачественные очищенные материалы.
Принцип работы свинцового аккумулятора:
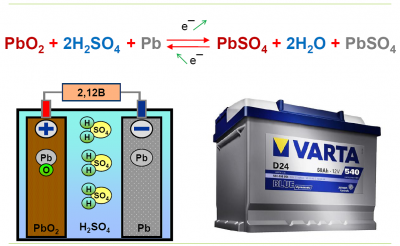
Конструкция гелевых и кислотных АКБ идентична. Одно различие, что в гелевых батареях в электролит добавлен загуститель SiO2. Зачем это надо? Ведь добавление примеси в электролит повышает сопротивление, а значит, снижает КПД батареи. Это тенденция времени, клиент хочет поставить АКБ, например, на поломоечную машину и больше о ней не думать. Исходя, из потребности времени, был и создан некий переходной вариант необслуживаемой батареи ГЕЛЕВЫЕ. Почему переходной? Производители уже вплотную занимались и занимаются разработкой батарей типа OPTIMA. Конструкция батарей OPTIMA, кардинально отличается от кислотных и гелевых.
Конструкция батарей OPTIMA:
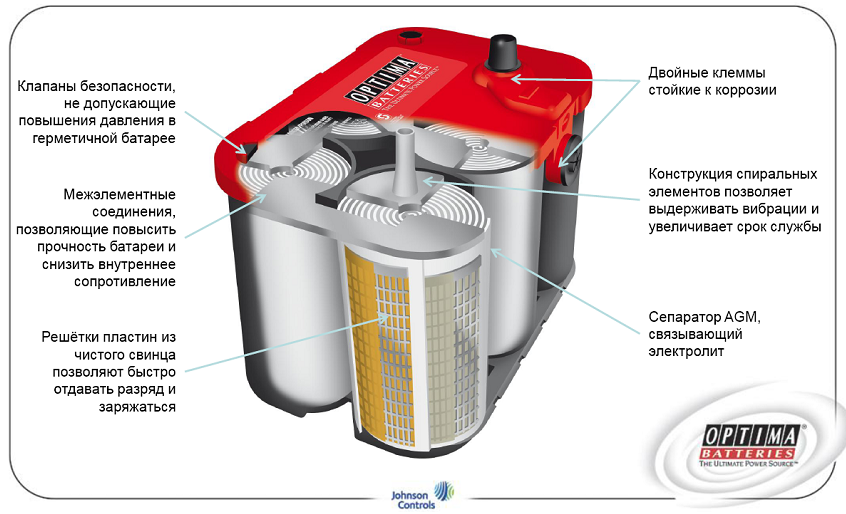
Так как на момент создания гелевых батарей, батареи OPTIMA были дорогие и технологии не до конца проработаны, были и сделаны гелевые батареи. А значит гелевые батареи это временное решение, которое будет заменено в ближайшем будущем необслуживаемыми, герметичными батареями OPTIMA. Либо же потребитель будет использовать кислотные батареи.
МИФЫ.
-
Кислотные батареи при зарядке выделяют вредные газы. В кислотных батареях прошлого века можно было об этом говорить, сегодня же кислотные батареи не выделяют вредных газов. С чем это связано? В производстве батарей для связки активной массы раньше использовалось такое вещество, как СУРЬМA (Sb), оно действительно выделяло газы, кстати, это же вещество использовалось и в производстве гелевых батарей. Сегодня ни один серьезный производитель не использует СУРЬМУ (Sb), а вместо этого используется Кальций (Са), который не выделяет газов. Что происходит во время зарядки батарей? Из позитивно заряженных эл. пластин (Диоксид свинца — PbO2) выделяется водород, из негативно заряженных эл. пластин (Свинец — Pb) выделяется кислород. А значит, из кислотной батареи во время зарядки выделяется кислород в очень малых количествах. Малые выделения газов достигнуто, благодаря тому что: a. СУРЬМA (Sb) заменена на кальций, b. используются импульсные зарядки, которые заряжают АКБ малыми токами и не дают закипать электролиту, закипание происходит лишь в последней стадии зарядки и продолжается не более 5—10 минут.
-
Гелевый АКБ герметичен и не выделят газов. Это не правда. Так как конструкция АКБ точно такая же, как и у кислотных и реакция происходит точно такая же. И газы водорода и кислорода тоже вырабатываются, газы поднимаются в верхний отсек АКБ, там конденсируются (превращаются в воду и попадают опять в гель). Но если повысить зарядные токи (например зарядное устройство работает неправильно), что произойдет — начнется вырабатываться большое количество водорода, он будет накапливается, а так как в гелевом АКБ нет вентиляционных отверстий как в кислотных АКБ, при большом скоплении газа может произойти взрыв газа в АКБ. Что бы этого не произошло, АКБ оснащен выпускным клапаном, который в случае, если давление в АКБ превысит 2 атмосферы, должен открыться и выбросить наружу избытки газа. В кислотных АКБ такие опасные ситуации (взрыв, концентрированный выброс газа) исключены.
-
Кислотные батареи требуют постоянного ухода. Это занимает много времени. Это также не правда. Как уже было сказано выше, на сегодняшний день для зарядки АКБ применяются импульсные зарядные устройства, которые получая информацию от АКБ о степени заряда, подают именно тот ток, который необходим. Зарядные устройства оснащаются термодатчиками, которые не допускают закипания электролита. А значит, электролит не выкипает. Исходя из практики периодичность доливки воды в тяговые кислотные батареи не чаще чем раз в пол года. А значит, раз в пол года вам надо потратить 10 минут, что бы долить воду и все.
-
Гелевый АКБ купил и забыл. Это правда, купил, поработал максимум год и выбросил. Стандартная гелевая АКБ рассчитана на 400, дорогая максимум 700 циклов зарядки и разрядки. Что это значит, что при правильной эксплуатации, АКБ проработает максимум 2 года. Еще раз подчеркиваю при правильной. Правильная эксплуатация гелевой батареи. Гелевую батарею обязательно надо разряжать на 80% и потом заряжать 12 часов не менее. Почему? Так как в АКБ находится гель, он обладает значительной плотностью, а это значит, что водороду и кислороду сложно добраться до сепаратора, на это нужно много времени. Для полной зарядки, например АКБ 70Ач для поломоечной машины необходимо 12 часов. На таких АКБ поломоечная машина работает 60 минут, а потом снова на зарядку и снова на 12 часов. Если мы систематически не до заряжаем АКБ что происходит? АКБ (гелевый) заряжается сверху вниз. Если мы заряжаем АКБ например 5 часов, то заряд в нижней и верхней части АКБ различается, верхней части АКБ заряжен, а в нижней разряжен. Со временем серная кислота преобразуется в сульфат свинца и нижняя часть АКБ уже не заряжается, до нее не доходят газы водорода и кислорода. АКБ посылает информацию зарядному устройству, что он заряжен и зарядка отключается. После чего мы наблюдаем, что АКБ не работает 60 минут (чего и так очень мало), а 40 минут, потом, 30 и все, про АКБ можно действительно забыть, сделать с ним уже ничего нельзя. Так как он не обслуживаемый. Данная ситуация не может иметь место в кислотных АКБ, так как плотность воды низкая и газы без особых усилий за короткое время доходят до сепаратора, и батарея заряжается полностью. Поэтому кислотные АКБ можно до заряжать, ничего с ними не будет. Преимущество кислотных АКБ также в том, что количество циклом заряда и разряда доходит до 1500 (4 года). А это значит, что кислотный АКБ прослужит вам в 2 а то и в 3 раза больше чем гелевый. А если вдруг что, всегда можно слить электролит, залить новый с необходимой плотностью и работать дальше.
Сводная таблица
| Параметр | Кислотные (110 Ач) | Гелевые (70Ач) |
| Емкость | Аналогичный по размеру (Д/Ш/В). Низкое сопротивление из за жидкого электролита. Большее количество рамок с активным веществом | Аналогичный по размеру (Д/Ш/В). Значительное сопротивление из за геля. Меньшее количество рамок с активным веществом |
| Время работы на одной зарядке | 180 мин | 60 мин |
| Выброс газов | Незначительное выделение кислорода при зарядке. | При перезаряде концентрация водорода, может или взорваться в АКБ, или же произойдет концентрированный выброс газа через выпускной клапан. |
| Количество циклов заряда разряда | От 400 (1 год) до 700 (2 года) | |
| Обслуживание | Один раз в 3—6 месяцев долить дистиллированную воду | Необслуживаемый |
| Запуск АКБ | АКБ полностью готов к работе | Необходимо провести минимум 4 цикла заряда и разряда АКБ, что бы активизировать гель |
| Время зарядки АКБ | 12 часов | 12 часов |
| Возможность краткосрочной до зарядки АКБ, | Да | Нет (эффект памяти, если систематически до заряжать гелевый АКБ, время его работы значительно сократится) |
| Стоимость | Низкая | Высокая |
Вывод
Исходя из всего вышеперечисленного относительно кислотных и гелевых АКБ, решать Вам! Купить ли вам дорогие, но очень привередливые гелевые АКБ, либо относительно не дорогие, но по всем характеристикам существенно превосходящие кислотные АКБ.
Вся информация основана на материалах семинара, организованного 06.06.12 компанией «БатАвтоТрайд». Семинар проводил Инженер ведущего мирового производителя Аккумуляторных батарей «Jonson Controls», выпускающие такие АКБ, как VARTA, BOSCH, OPTIMA и др.
Kак взрываются литий-ионные аккумуляторы / Habr
Последнее время тема самовозгорания литий-ионных аккумуляторов часто мелькает в заголовках новостей: то смартфон загорится, то ховерборд, а то и автомобиль. Так что же происходит внутри аккумулятора во время термического разгона и почему возникает самовозгорание?
Литий-ионные аккумуляторы состоят из анода и катода, разделённых пористым полимерным сепаратором. Активным материалом катода чаще всего являются оксиды переходных металлов со встроенными в кристалл ионами лития. В аноде обычно используется графит. Электролит, которым залита электрохимическая ячейка, представляет собой органический раствор солей лития. При первой зарядке, производимой фирмой-изготовителем, при встраивании лития в анод на электродах (особенно на аноде) образуется защитный ион-проводящий слой (SEI), состоящий из разложившегося электролита. Этот слой защищает электроды от паразитических реакций с электролитом.
Чаще всего причиной самовозгорания аккумуляторов является короткое замыкание внутри электрохимической ячейки. Электрический контакт между анодом и катодом может возникнуть по многим причинам. Это может быть, например, механическое повреждение ячейки. Ещё внутреннее короткое замыкание возникает из-за нарушения технологии производства при неровной нарезке электродов или попадании металлических частиц между анодом и катодом, что ведёт ко повреждению пористого сепаратора. Также причиной внутреннего короткого замыкания может быть «прорастание» цепочек металлического лития (дендритов) через сепаратор. Такой эффект возникает, если ионы лития не успевают встроиться в кристалл анода при слишком быстрой зарядке или низкой температуре, а также если ёмкость активного материала катода превышает ёмкость анода, в результате чего на поверхности анода появляются микроскопические отложения, которые постепенно растут.
Итак, после того, как произошло короткое замыкание, аккумулятор начинает нагреваться. Когда температура достигает 70-90 °C, ион-проводящий защитный слой на аноде начинает разлагаться. А дальше литий, встроенный в анод, вступает в реакцию с электролитом, выделяя летучие углеводороды: этан, метан, этилен и т.д. Но, несмотря на наличие такой взрывоопасной смеси, возгорания не происходит, так как в системе пока нет кислорода.
Так как реакции с электролитом экзотермические, температура и давление внутри аккумулятора продолжают повышаться. Когда температура достигает 180-200 °C, материал катода, обычно представляющий из себя оксид переходных металлов со встроенным в кристалл литием, вступает в реакцию диспропорционирования и выделяет кислород. Вот тут-то и происходит самовозгорание и ещё более резкий скачок температуры. Параллельно идёт термическое разложение электролита (200-300 °C), также выделяющее тепло. Выглядит это так:
И, в конце концов, в реакцию с электролитом (если он ещё остался) вступает графит, а когда температура достигает 660 °C, плавится алюминиевый токоприёмник. Выше 900°C температура обычно не поднимается, так как разлагаться уже нечему.
Помимо внутреннего короткого замыкания существуют и другие причины самовозгорания: перегрев аккумулятора, неправильная зарядка/разрядка (превышение максимально допустимого напряжения, зарядка на высоких токах, слишком глубокая разрядка), и т.д. Но все эти причины приводят к одному результату: термическому разгону и разложению электролита при взаимодействии с электродами. Различаются только порядки вышеописанных реакций и их скорость.
Естественно, производители аккумуляторов предусмотрели системы защиты от самовозгорания, и чем больше и мощнее аккумулятор, тем больше степеней защиты он содержит. Одним из видов защиты от небольшого короткого замыкания является пористый сепаратор, который при локальном повышении температуры становится непроницаемым и препятствует, к примеру, дальнейшему росту дендритов внутри аккумулятора. Но иногда температура повышается слишком быстро, и сепаратор просто плавится, в результате чего анод соприкасается с катодом.
Также аккумуляторы оборудованы предохранителями и клапанами, которые при повышении давления и температуры внутри либо отключают электроды от цепи, либо способствуют выходу наружу скопившегося газа. В последнем случае, так как газы легковоспламеняющиеся, при контакте с кислородом снаружи возникает пламя. Пример действия защитных клапанов можно было наблюдать при аварии с участием автомобиля Тесла Model S, где аккумулятор был пробит крупным металлическим предметом. Так как в Тесле клапаны аккумуляторов были направлены вниз на асфальт и отдельные блоки были хорошо изолированы друг от друга, сгорела лишь передняя часть аккумулятора (как сказал Элон Маск, если бы тот же металлический предмет пробил бак с бензином, машины бы сгорела целиком).
Кстати, термическая изоляция отдельных блоков в крупном аккумуляторе очень важна. Если в вышеупомянутом примере аккумулятор Теслы не загорелся полностью из-за хорошей термоизоляции, то в случае аккумулятора на борту Боинга 787 самовозгорание произошло из-за того, что блоки были недостаточно изолированы друг от друга, что привело к перегреву всей системы.
Также литий-ионные аккумуляторы оснащены контроллерами, сенсорами, балансирами заряда, и т.д. Подробнее про системы безопасности аккумуляторов можно почитать тут.
Как видно из этого поста, самый опасный компонент аккумулятора- электролит, который разлагается на легковоспламеняющиеся компоненты при повышении температуры. На сегодняшний день учёные пытаются найти более стабильные альтернативы: ионные жидкости, полимерные электролиты, твёрдотельные керамические электролиты и т.д. Но это-отдельная тема…
Источники:
» Journal of The Electrochemical Society, 158 3 R1-R25 2011
» Journal of Power Sources 208 (2012) 210– 224
» www.electrochem.org/dl/interface/sum/sum12/sum12_p037_044.pdf
» www.powerinfo.ru/accumulator-liion.php
» www.treehugger.com/cars/elon-musk-letter-explains-why-tesla-model-s-caught-fire.html
Свинцовые аккумуляторы кипение — Справочник химика 21
В конце заряда происходит только электролиз воды, поэтому выделение пузырьков газа ( кипение ) служит признаком окончания заряда свинцового аккумулятора. [c.365]При форсированном заряде свинцовых аккумуляторов наблюдается кипение электролита и выделение пузырьков газа. Это выделяется водород, образующийся за счет разложения (электролиза) воды и электролита. Водород — горючий газ, при смешивании с воздухом образует взрывчатую смесь гремучий газ . При содержании водорода 4,5—5% смесь горюча, а при 6% и более горение переходит во взрыв. Наибольшим разрушительным действием обладает смесь, содержащая около 28% водорода. [c.288]
Электролитом для свинцовых аккумуляторов служит раствор серной кислоты. Концентрированная серная кислота представляет собой прозрачную жидкость без цвета и запаха, имеющую маслянистую консистенцию. Плотность ее равна 1,84 г/см при 10 °С, содержание в ней чистой кислоты составляет около 95 %. Чистая серная кислота хорошо смешивается с водой в любых пропорциях. При смешении ее с водой выделяется большое количество теплоты. Концентрированная серная кислота имеет точку кипения 33 С. При нагревании она выделяет серный ангидрид в виде газа, который, поглощая водяные пары из воздуха, образует густой туман. [c.32]
Левый электрод аккумулятора представляет собой электрод второго рода, а правый — окислительно-восстановительный. Прн зарядке аккумулятора применяют напряжение около 2,5 В и доводят раствор электролита до кипения , т. е. до разложения воды. Существенно, что при зарядке благодаря большому перенапряжению водорода на свинце электролиз воды при разности потенциалов на электродах, близких к 2 В, не происходит, а идет выделение свинца и окисление РЬ до РЬ . Недостатком свинцового аккумулятора является его большая масса. Значительно меньшую массу при такой же емкости имеет никелевый аккумулятор, предложенный Т. Эдиссоном. Он представляет собой цепь [c.195]
Электролитом свинцовых аккумуляторов служит серная кислота, которая представляет тяжелую маслянистую жидкость плотностью 1,84, содержащую 98,2% h3SO4 и 1,8% воды. Темгге-ратура кипения 338″. При взаимодействии серной кислоты с водой выделяется большое количество тепла. Например, при растворении одного моля h3SO4 в 50 молях воды выделяются 17 100 кал. Серная кислота при этом вступает в хими-4ei Koe взаимодействие с водой, образуя ряд химических соединений, имеющих различные температуры плавления. [c.330]
Газовые аккумуляторы… Информации о них пока очень мало, и даже Гугл с Яндексом мало знают про такое, так что информация собирается по крупицам, но если верить друзьям из Китая, то сейчас полным ходом идёт их запуск в производство, и уже сейчас можно заказать где-то за 100 долларов. Где именно — не известно, но факт остаётся фактом.
По словам знающих людей, заправляются такие источники электроэнергии обычными газовыми баллончиками для зажигалок, причём баллона хватает на 10 циклов заряда любого смартфона. Да, эта штука преобразовывает газ в ток. Устройство является портативным аккумулятором со стандартным USB-портом, от которого можно заряжать любые мобильные девайсы.
Вес газового аккумулятора составляет примерно 200 граммов, для полной заправки ёмкости аккумулятора достаточно 40 граммов газа, а процесс закачки газа в Kraftwerk (так вроде называется девайс) составляет всего несколько секунд. Но устройство не вечно — спустя примерно 100 циклов придётся заменить электроды (покупаются отдельно). Массовый старт продаж намечен на начало 2016 года по рекомендованной розничной цене $100. Производители утверждают, что такой Power Bank абсолютно безопасен для транспортировки в кармане или в багаже.
Принцип работы газового аккумулятора токаОстаётся вопрос — как же он работает? Ноу-хау не раскрывается, но можно предположить, что принцип действия был давно известен ещё в СССР. Первый газовый аккумулятор был изобретен в 1955 году инженером А. Пресняковым. В любом аккумуляторе есть положительные и отрицательные пластины с активным веществом, состоящим из различных металлов. В качестве токопроводящей среды обычно применяются водные растворы кислот или щелочей. При погружении пластин в электролит начнет происходить химическая реакция, и если их замкнуть через измерительный прибор, мы обнаружим, что во внешней цепи проходит электрический ток. Во время работы аккумулятора, а также при его зарядке можно заметить, что на пластинах выделяются пузырьки газа. Газы, как правило, не участвуют в реакциях и выполняют в электрохимических процессах вспомогательную роль, так что в обычных аккумуляторах разность потенциалов определяется только свойствами металлов, из которых состоят пластины. Но, оказывается, различные газы тоже обладают вполне определенным электрохимическим потенциалом. Значит, эту способность можно использовать для изготовления аккумулятора, в котором роль активного вещества будут выполнять два различных газа. Важное преимущество газового аккумулятора — простота устройства и высокая экономичность. Для его изготовления не требуются цветные металлы и дорогостоящие материалы. Газовый аккумулятор можно долго хранить как в заряженном, так и в разряженном состоянии, и это не отразится на его работоспособности. Он допускает большой зарядный ток, что уменьшает время зарядки. Даже длительные замыкания пластин между собой безвредны для газового аккумулятора, так как в этом случае он хоть и разряжается, но без необратимых процессов в самом активном веществе, как в других типах аккумуляторов. Газовые аккумуляторы — конструктивно новые источники тока. Их создание стало возможным только после того, как были найдены вещества, способные поглощать газы в большом количестве и удерживать их в себе. Такие вещества называются адсорбентами. Один из лучших адсорбентов — активированный уголь. Поглощая газы, он сам не участвует в химических реакциях. Конструкция газового аккумулятораКонструкция самодельного газового аккумулятора показана на рисунке ниже. В емкость 1 налит электролит 2. В электролит опущены два электрода, которые состоят из стержня 3 и мешочка 4 с активированным углем 5. Предохраняет мешочки от смещения перегородка 6, которая изготовляется из любого электроизоляционного материала. Емкость закрывается крышкой 7.
Работает аккумулятор так. При зарядке, когда к электродам подключено напряжение, электролит разлагается на водород и хлор. Электрод, присоединенный к отрицательному проводу, будет поглощать водород, а к положительному — хлор. Таким образом, создается разность потенциалов. Химическая реакция может быть описана уравнением:
В качестве электролита в газовых аккумуляторах можно применять растворы различных солей, кислот и щелочей. Подбирая электролит, можно осуществить его электролиз на те или иные газы и получить различную электродвижущую силу и емкость аккумулятора. Так, при электролизе слабого раствора серной кислоты получим пару водород — кислород. Раствор питьевой соды даст пару водород — углекислый газ. Вообще подбор электролита открывает очень широкие возможности для эксперимента. Источник: Журнал «Юный техник».
Так что, может новинка заменить стандартные литиевые АКБ? В некоторых случаях да. Если нужен Повер Банк в условиях, когда ближайшая розетка 220 В километрах в 100 — проще взять с собой пару недорогих газовых баллончиков. А по мере поступления новых данных про эту вещь, будем выкладывать их здесь в комментариях. |
Каковы причины закипания автомобмильного аккумулятора?
По какой причине кипит аккумулятор на автомобиле, знает далеко не каждый. Начинающие автолюбители порой даже не слышали о таком явлении. Между тем, последствия зачастую бывают довольно серьёзные и неприятные.
Каждый технологический процесс должен укладываться в определенные нормативные рамки. И если аккумуляторная батарея начала «кипеть», то это повод задуматься – а все ли с ней в порядке и чем это грозит.
В статье рассмотрим явление, которое в народе называют «закипел аккумулятор». Чаще встречается выражение «закипел радиатор». Оказывается – кипеть может и то, и другое.
Каковы причины закипания аккумулятора?
Нельзя однозначно утверждать, что явление «кипение аккумулятора» является химическим или физическим процессом. Как известно, при приготовлении электролита применяют 38% серную кислоту, которая при плотности 1,84 г/см3 закипает при температуре +337°С. Дистиллированная вода кипит при температуре 100°С. Используемый в аккумуляторах электролит имеет температуру физического кипения, при которой начинается образование пузырьков, ~113°С.

Автомобильный аккумулятор может закипать по нескольким причинам:
Перезаряд АКБ в процессе эксплуатации
Может возникать из-за неисправности реле-регулятора напряжения в генераторе.

Перезаряд также может происходить, если применять зарядное устройство с ручной регулировкой зарядного тока. Номинальный ток заряда – 10% от емкости АКБ. Но если вы значительно превышаете это значение, то есть высокая вероятность что аккумулятор закипит или вовсе выйдет из строя.
Короткое замыкание банок
Короткое замыкание банок может быть как на бэушных, так и на новых батареях. В связи с экстремальными условиями эксплуатации АКБ (постоянная вибрация) межпластинные зоны и сепараторы разрушаются, что в конечном итоге может привести к их закорачиванию.
Резкое закипание электролита вызывает большой ток, который протекает при коротком замыкании.
Сульфатация пластин
Сульфатация пластин приводит к снижению емкости батареи. Следствие этого является недозаряд АКБ и быстрый саморазряд, в результате которого номинальное напряжение батареи может быть ниже 10 В. В результате при зарядке такой аккумуляторной батареи протекает большой ток, который приводит к процессу кипения.

Следует учитывать, что заряжать сильно разряженный аккумулятор от генератора автомобиля не рекомендуется. Это может вызвать закипание АКБ и выход из строя генератора.
Перегрузка электрической бортовой системы
Если при эксплуатации автомобиля одновременно использовать несколько энергоемких потребителей (отопительную систему, кондиционер и др.), то аккумулятор может перегреваться, особенно в летний период. А перегрев может вызывать закипание.
Процесс «кипения» АКБ визуально можно наблюдать только на обслуживаемых аккумуляторах. На необслуживаемых аккумуляторах процесс кипения можно обнаружить только на слух, при использовании специальных устройств.
Посмотреть как кипит аккумулятор на работающем автомобиле можно ниже.
Газовыделение в процессе заряда и саморазряда аккумулятора
Если аккумулятор полностью или почти полностью заряжен, но всё еще подключен к зарядному устройству и заряжается, то в банках начинается процесс газовыделения. Заряженным аккумулятор считается тогда, когда в процессе заряда его плотность уже не растет на протяжении продолжительного времени и при этом электролит кипит и обильно выделяются газы.
Газовыделение также наблюдается при перезаряде аккумулятора, когда реле-регулятор или зарядное устройство выдает напряжение выше 14,4 вольт.
Также явление «кипения» наблюдается при саморазряде аккумулятора. Если заглянуть в банки, то можно наблюдать, как периодически из электролита поднимаются пузырьки газа.
В процессе заряда интенсивность выделения пузырьков нарастает постепенно. На начальном этапе со стороны батареи может быть слышно легкое шуршание, позднее – хорошо различимое бульканье. Если вы не планируете доливать дистиллированную воду, то во избежание разбрызгивания электролита рекомендуется не выкручивать полностью и вынимать пробки, а только ослабить их, оставив при этом щель для отхождения газов.
Признаком неисправности является ситуация, когда кипеть аккумулятор начинает сразу после подачи зарядного тока или через несколько минут после этого. Моментальное начало выделения газа свидетельствует о том, что имеет место сильная сульфатация пластин или разрушены пластины.
Электролиз в аккумуляторной батарее
Каждый автовладелец прекрасно знает, что в обслуживаемый аккумулятор время от времени нужно добавлять дистиллированную воду.
Куда же она девается из закрытого корпуса? Исчезнуть из батареи она может двумя путями: при жаре она испаряется через систему вентиляции либо происходит процесс, который мы сейчас рассмотрим.
Вследствие потерь аккумулятором дистиллированной воды в нем возрастает плотность электролита, что в свою очередь приводит к сульфатации пластин .
Вода расходуется на электролиз воды.
Электролиз – это электрохимический процесс, который происходит между двумя электродами, размещенными в электролите. Положительный электрод называется анодом, а отрицательный – катодом.
При электролизе в электродном процессе вода принимает участие как в роли окислителя, восстанавливаясь на катоде, так и в роли восстановителя, окисляясь на аноде.
При прохождении тока через электроды изменяются их потенциалы – возникает электродная поляризация. Потенциал катода двигается в отрицательную сторону, потенциал анода – в положительную сторону. Поляризация электродов зависит от плотности тока и температуры.
Вот при этих условиях происходит электролиз (разложение) воды. Под воздействием этого электрохимического процесса вода разлагается на водород и кислород. При этом кислород образуется на положительных пластинах, а водород образуется на отрицательных. Водорода в процессе этого разложения получается в два раза больше, чем кислорода, т.е. отрицательные пластины выделяют больше газа, чем положительные пластины.
Почему взрываются автомобильные аккумуляторы?
Если вспомнить школьные уроки химии, то тогда водород еще называли по-другому – «гремучий газ».
Почему он имеет такое название – не трудно догадаться. В определённой пропорции смешивания водорода и кислорода такая смесь взрывается от малейшей искры или открытого огня. Именно благодаря кипению аккумулятора (явлению электролиза воды), в аккумуляторе с неисправной системой вентиляции время от времени скапливается эта гремучая смесь. Это иногда приводит к взрыву аккумулятора.
Батарея взрывается, весь капот и мотор в электролите, пластик кусками – никому не пожелаешь такого развития событий.

Для того чтобы исключить и предотвратить такие негативные явления, аккумуляторы имеют в вентиляционных отверстиях искрогаситель.
В прогрессивных конструкциях АКБ имеется микропористый полимерный искрогаситель, через который внутреннее пространство батареи сообщается с атмосферой. Испарения электролита в ячейках специального сепаратора конденсируются и возвращаются в аккумулятор, не попадая на клеммы аккумулятора и электрическую проводку.
Основное же предназначение искрогасителя — предотвратить попадание внутрь АКБ искр, из-за которых может взорваться гремучий газ, образующийся при электролизе воды.
Никогда не курите и не чиркайте спичками и зажигалкой вблизи заряжающегося аккумулятора.
Крокодильчики зарядных устройств подключайте к клеммам аккумулятора всегда перед включением зарядника в сеть, а отключайте после выключения устройства от электросети, так как в противном случае при подключении могут проскочить искры и если при зарядке скопился вышеупомянутый “гремучий газ” может произойти взрыв.
Почему не кипит разряженный (недозаряженный) аккумулятор?
Всем известно, что поставленный на зарядку нормальный аккумулятор не кипит. А почему? Потому что ток, который подается из зарядного устройства на АКБ, первоначально расходуется на электрохимическую реакцию разложения сульфата.
При разряде аккумулятора на положительных и отрицательных пластинах образуется сульфат свинца, что является естественным результатом процесса разряда. Такой сульфат при заряде без всяких затруднений превращается в активные вещества. Термин неисправности «сульфатация пластин» применяется в том случае, когда разряженные (т.е. покрытые слоем сульфата свинца) пластины не заряжаются при обычном заряде.
Сульфат свинца, образовавшийся в условиях нормального разряда, состоит из мелких кристаллов, равномерно распределенных в пористой и хорошо проводящей ток активной массе. При последующем заряде такой сульфат вновь легко переходит в двуокись свинца и свинец.
При недопустимо глубоких разрядах активная масса пластин почти полностью переходит в сульфат, причем в ряде случаев сульфат из мелкокристаллического состояния переходит в крупнокристаллическое.
При этом если в АКБ присутствуют поверхностно-активные органические вещества, то на кристаллах сульфата свинца отрицательных пластин происходит адсорбция этих веществ, в результате чего снижается скорость растворения кристаллов.
Внутреннее электрическое сопротивление активной массы при этом резко возрастает. Сульфат полностью покрывает частицы проводящей активной массы, и прохождение тока через пластины прекращается. Кроме этого изменяется потенциал, при котором начинается газовыделение при заряде.
Переход образовавшегося в пластинах адсорбированного сульфата в двуокись свинца и свинец становится в этих условиях неосуществимым, и аккумулятор теряет часть емкости, а при очень глубокой сульфатации — почти всю емкость, о чем мы писали в предыдущей статье.
Причинами образования крупных кристаллов сульфата свинца могут быть:
- систематические, чрезмерно глубокие разряды аккумуляторов;
- регулярные недозаряды;
- пребывание батарей в полуразряженном или разряженном состоянии в течение длительного времени;
- низкий уровень электролита.
Когда же АКБ почти полностью зарядилась и растворимого сульфата на пластинах уже осталось мало, то некоторая часть тока, подаваемого на клеммы, оказывается избыточной.
Куда деваются излишки тока?
Правильно, в батарее начинается процесс электролиза, т.е. разложение воды на водород и кислород. Поэтому батарея и начинает «кипеть».
По этой причине не заряженная АКБ не закипает в процессе заряда, а уже зарядившаяся – «кипит». Это является признаком того, что батарея зарядилась и перестала принимать заряд.
Как рассчитать зарядный ток и почему он зависит от ёмкости аккумулятора?
Так же процесс закипания начинается при перезаряде, т.е. когда на АКБ подается зарядного тока больше, чем требуется для нормального протекания процесса электролиза.
Как рассчитывается зарядный ток? Номинальную ёмкость, допустим, 60 А/ч, необходимо поделить на 10. Подробней можно посмотреть здесь. Для батареи с такой номинальной ёмкостью зарядным током будет считаться 6 А.
Почему приняли такую величину?
Для нормального протекания электрохимического процесса растворения кристаллов сульфата необходимо определенное количество тока. Это количество напрямую связано с площадью активных пластин АКБ, т.е. его ёмкостью.
Ёмкость аккумулятора рассчитывают исходя из общей площади активных областей в аккумуляторной батарее. Зарядный ток аккумулятора напрямую зависит от ёмкости аккумулятора.
Под сульфатацией понимается химический процесс, когда при нормальном режиме заряда кристаллы сульфата перестают растворяться, что является причиной резкого уменьшения активной площади пластин аккумулятора. Далее следует цепная реакция: уменьшается емкость АКБ, следовательно, уменьшается пусковой ток.
При заряде АКБ мы применяем величину зарядного тока, рассчитанную по номинальной ёмкости (для 60-ти АКБ – 6 А). А если емкость уменьшилась до 40 А/ч, то 2 А оказываются лишними.
Эти 2 излишних ампера начинают участвовать в реакции разложения воды в процессе электролиза. Батарея начинает «закипать».
Что делать, если кипит аккумулятор?
Самое главное — нужно выяснить причину закипания.
1. Зачастую используется метод замены на 100% исправную деталь. Можно взять у соседа нормальную батарею и установить на свой автомобиль. Если аккумулятор так же закипает при работающем двигателе, значит проблема не в вашей АКБ, а причина может крыться в реле-регуляторе генератора. Проверить его можно самому, посмотрев видео — https://www.youtube.com/watch?v=eFsHEJjt1PQ
2. Если батарея не держит нагрузку, то необходимо её протестировать с помощью нагрузочной вилки (ссылка на статью Нагрузочные вилки). Если при подключении нагрузки напряжение опускается ниже отметки 10 В, значит, у вашей батареи возникли серьёзные проблемы. Вероятной причиной такой ситуации является сульфатация. Если аккумулятор обслуживаемый то в некоторых случаях при визуальном осмотре можно обнаружить белый налет на пластинах, который называется сульфатация. Для снижения уровня сульфатации можно попробовать применить зарядное устройство с режимом десульфатации, например, Вымпел-57.
Как проверить аккумуляторную батарею с помощью нагрузочной вилки посмотрите ниже в видео:
3. Можно предположить, что в аккумуляторе замыкание банок.
Определить короткое замыкание визуально можно только на обслуживаемых АКБ при выкрученных пробках. Допустим, вы подключили аккумулятор к зарядному устройству и увидели, что через 3-5 минут в одной или нескольких банках наблюдается явно выраженное выделение водорода. Это означает, что данная банка замкнута.
При замкнутой банке ваша батарея будет не способна запустить двигатель вашего автомобиля, так как в момент пуска напряжение на АКБ просядет ниже 10 В.
Замкнутая банка – это еще и пониженная инерция, а значит напряжение заряда от генератора 14 В будет слишком высоким и превратит ваш аккумулятор в электролизер, где из воды выделяется водород. Вы можете почувствовать запах сероводорода.
Вариантов устранения короткого замыкания два – замена поврежденной банки или замена аккумулятора. Первый вариант доступен только на обслуживаемых аккумуляторах.
Как определить короткое замыкание в банке —
Если вы обнаружите, что аккумулятор начинает кипеть, не нужно прежде времени паниковать. Обладая элементарными знаниями химических процессов, происходящих в аккумуляторе при эксплуатации, постарайтесь просто спокойно выявить причину и принять меры к устранению.
При зарядке аккумулятор кипит — это нормально или нет? Узнайте, почему при зарядке аккумулятора кипит электролит
Многие автовладельцы сталкивались с тем, что при зарядке аккумулятор кипит. Кого-то это не смущает, некоторые же, наоборот, отключают зарядное устройство (ЗУ). Существует несколько актуальных способов того, как можно восстановить энергию батареи до 100%. При этом пузырьки могут как отсутствовать, так и присутствовать. Давайте разберёмся с тем, как нужно заряжать АКБ, и должно ли проявляться данное явление.

Кипение электролита: нормально или нет?
Итак, после того как вы подключили ЗУ к клеммам АКБ, то замечаете, что несколько или сразу все банки, в которых содержится жидкость, начинают вести себя нестабильно. Это вполне нормальное явление, но тут есть свои нюансы. Если вы только подключили батарею и обнаружили закипание нескольких банок, то такое устройство можно выбросить. Такое явление говорит о том, что имеются замкнутые пластины и вряд ли будет толк с такой АКБ.
Если вы заметили, что при зарядке аккумулятор кипит, то не нужно пугаться — это нормально. По сути, это не кипение. Образование пузырьков в банках свидетельствует о том, что выделяется гремучий газ, другими словами, происходит электролиз. В таком состоянии электролит имеет нормальную температуру и не повышается до предельного максимума (выше 45 градусов по Цельсию). Давайте разберёмся с тем, почему появляются пузырьки.
Почему кипит аккумулятор?
Как правило, газ начинает выделяться тогда, когда батарея уже полностью заряжена, и сейчас вы поймёте, почему. Так как мы имеем ограниченную ёмкость, то бесконечно накапливать электрическую энергию, хранящуюся в химическом виде, мы не можем. Следовательно, когда батарея полностью заряжена, то вся поступающая энергия преобразуется в гремучий газ.
Вы должны понимать, что ни при каких обстоятельствах не рекомендуется выполнять зарядку необслуживаемой батареи при засоренной газоотводящей трубке. Обусловлено это тем, что аккумулятор кипит, а энергия не может уходить, так как крышка закрыта. Не раз бывали случаи, когда банки АКБ попросту разрывало. Тем не менее, выполнять подзарядку всё же можно, но нужно стараться не заряжать батарею более чем на 80-90% от максимума. Теперь вы знаете, что процесс появления пузырьков вполне нормален. Как только они начинают образовываться, нужно отключать зарядное устройство, после чего можно устанавливать батарею на место.
Подготовительные работы перед подзарядкой
Прежде чем начать процесс, нужно снять АКБ и поставить на горизонтальную поверхность. Желательно, чтобы всё делалось в вентилируемом помещении, так как выделяется ядовитый, к тому же взрывоопасный газ. Далее необходимо открутить все банки (это что касается обслуживаемых батарей). Сделать это можно при помощи большой плоской отвёртки, иногда даже руками. Мы должны увидеть электролит: если его уровень ниже обычного, то доливаем воды (дисцилят). После того как вы полностью установили нормальный уровень, можно подключать зарядное устройство.
Тут главное — не перепутать. Подключаем плюс ЗУ к плюсовой клемме, ну и минус — соответственно. Зарядное устройство имеет два провода: красный и чёрный, «+» и «-». АКБ заряжается, мы наблюдаем. Если ёмкость батареи составляет 60 Ач, а ток 6 ампер, то 10 часов достаточно, чтобы полностью зарядить устройство. Но обратите внимание, что если при зарядке аккумулятор кипит и началось это в самом начале, то это явный сигнал того, что нужно снизить ток. Таким образом вы сможете избежать порчи. Тем не менее, нужно понимать, что аккумулятор при зарядке должен кипеть, но не слишком интенсивно.
Немного о правильной зарядке
Современные АКБ подразумевают использование тока, равного 1/10 от общего объёма. Так, батарею 12В 60 Ач нужно заряжать током не более 6 ампер. Но такой метод используется не всегда. Например, исключением является полный разряд батареи. В этом случае нужно использовать пониженное напряжение, примерно 2 ампера. Изредка используется форсированный метод зарядки АКБ. Нельзя не отметить, что это крайне негативно воздействует на устройство, так как мы используем ток, равный 60-70% общей емкости. Если батарея 60 Ач, то мы заряжаем примерно на 40-45 амперах. Большая вероятность того, что температура электролита поднимется до 45 градусов по Цельсию, в этом случае процесс нужно остановить.
Имеет место и уравнительный метод. В некоторых случаях он наиболее предпочтителен, так как позволяет полностью восстановить активные массы АКБ. Сила тока в этом случае равна 0,1 ампер. Следовательно, подзарядка таким образом займёт очень много времени, но на функциональности устройства это не отразится.
Несколько важных моментов
Далеко не все знают, что после того как батарея начинает кипеть, её можно заряжать еще некоторое время. Как показывает практика, в среднем, это 2-3 часа. После этого АКБ можно считать полностью готовой к эксплуатации. Если же при зарядке аккумулятора кипит электролит более длительное время, то это приведёт к перенасыщению и дальнейшему разрушению устройства. Также можно проверить плотность электролита, если она в диапазоне 1,28 то батарея заряжена, если ниже, то еще нет.
Не забывайте о том, что при длительном выделении пузырьков электролит постепенно выкипает, поэтому желательно вовремя отключать батарею от зарядного устройства. Также настоятельно не рекомендуется размещать АКБ возле открытых источников огня по понятным причинам. Желательно, чтобы зарядка осуществлялась в помещении, чтобы на батарею не попадал дождь или грязь. Также хотелось бы сказать о том, что не стоит размещать АКБ на неустойчивых поверхностях, тем более когда идёт процесс подзарядки.
Заключение
После прочтения данной статьи вы должны получить общее представление о том, почему появляются пузырьки. Как уже было отмечено выше, это вполне нормальное явление, однако процесс нужно контролировать и не допускать перезаряда. Процесс электролиза воды электролита наблюдается при зарядке постоянным током. Если же вы используете уравнительный метод, то появления пузырьков может и не быть. Что касается форсированного способа, то тут, наоборот, кипение может быть слишком интенсивным. В заключение хотелось бы сказать, что нужно соблюдать все требования и правила, описанные в данной статье, и тогда все будет в порядке. Если при зарядке аккумулятор кипит, то это сигнал к тому, что батарея почти заряжена и её нельзя оставлять в таком состоянии на ночь, так как это может привести к негативным последствиям.
Для умелых рук
Kак самим построить газовый аккумулятор? Газовый аккумулятор был изобретен в 1955 году советским инженером А. Пресняковым. Важное преимущество газового аккумулятора — простота устройства и высокая экономичность. Для его изготовления не требуются цветные металлы и дорогостоящие материалы. Эксплуатационные качества газового аккумулятора также весьма высоки.
Газовый аккумулятор можно долго хранить как в заряженном, так и в разряженном состоянии, и это не отразится на его работоспособности. Он допускает большой зарядный ток, что уменьшает время зарядки.Даже длительные замыкания пластин между собой безвредны для газового аккумулятора, так как в этом случае он хоть и разряжается, но без необратимых процессов в самом активном веществе, как в других типах аккумуляторов.Ниже приведена полная статья,посвященная газовым аккумуляторам.
Газовый аккумулятор
В любом аккумуляторе есть положительные и отрицательные пластины с активным веществом, состоящим из различных металлов. В качестве токопроводящей среды обычно применяются водные растворы кислот или щелочей. Такой раствор называется электролитом. При погружении пластин в электролит начнет происходить химическая реакция, и если их замкнуть через измерительный прибор, мы обнаружим, что во внешней цепи проходит электрический ток.
Во время работы аккумулятора, а также при его зарядке можно заметить, что на пластинах выделяются пузырьки газа. Газы, как правило, не участвуют в реакциях и выполняют в электрохимических процессах вспомогательную роль, так что в обычных аккумуляторах разность потенциалов определяется только свойствами металлов, из которых состоят пластины. Но, оказывается, различные газы тоже обладают вполне определенным электрохимическим потенциалом. Значит, эту способность можно использовать для изготовления аккумулятора, в котором роль активного вещества будут выполнять два различных газа.
Газовый аккумулятор был изобретен в 1955 году советским инженером А. Пресняковым. Важное преимущество газового аккумулятора — простота устройства и высокая экономичность. Для его изготовления не требуются цветные металлы и дорогостоящие материалы. Эксплуатационные качества газового аккумулятора также весьма высоки.
Газовый аккумулятор можно долго хранить как в заряженном, так и в разряженном состоянии, и это не отразится на его работоспособности. Он допускает большой зарядный ток, что уменьшает время зарядки. Даже длительные замыкания пластин между собой безвредны для газового аккумулятора, так как в этом случае он хоть и разряжается, но без необратимых процессов в самом активном веществе, как в других типах аккумуляторов.
Газовые аккумуляторы — конструктивно новые источники тока. Их создание стало возможным только после того, как были найдены вещества, способные поглощать газы в большом количестве и удерживать их в себе. Такие вещества называются адсорбентами. Один из лучших адсорбентов — активированный уголь. Поглощая газы, он сам не участвует в химических реакциях.
В таблице, помещенной ниже, показано, какое количество различных газов может быть поглощено одним граммом активированного угля при 15° С и нормальном давлении. Вы сразу же заметите закономерность: газ поглощается тем лучше, чем выше его критическая температура, то есть чем легче он сжижается.
Конструкция самодельного газового аккумулятора показана на рисунке 1. В емкость 1 налит элетролит 2. В электролит опущены два электрода, которые состоят из стержня 3 и мешочка 4 с активированным углем 5. Предохраняет мешочки от смещения перегородка 6, которая изготовляется из любого электроизоляционного материала. Емкость закрывается крышкой 7.
В качестве емкости газового аккумулятора с успехом могут быть использованы, например баночки для специй — они продаются в хозяйственных магазинах. Можно взять и стеклянные банки, но их надо покрыть снаружи асфальтовым лаком, чтобы свет не проникал внутрь, а то он будет способствовать разрядке аккумулятора. Мешочки изготовьте из старого капронового чулка плотной вязки. Шов можно сшить капроновой нитью или паяльником на круглой деревянной болванке. Один конец мешочка завяжите капроновой нитью наглухо, а во второй, открытый, вставьте угольный стержень от батареек карманного фонаря, отслуживших свой срок. Наполните мешочки активированным углем, хорошо уплотнив его. Загибая края мешочка, обвяжите их капроновой нитью вокруг стержня. Теперь нужно плотными витками обвязать мешочки. Чем больше будет сделано витков, тем лучше контакт угольного порошка со стержнем, тем меньше внутреннее сопротивление аккумулятора, тем он лучше работает.
Электроды нужно укрепить в крышке, а к выходящим наружу концам стержня приделать клеммы.
Лучше всего использовать медицинский уголь, который продается в аптеках, или уголь выбракованных противогазов. В крайнем случае древесный уголь можно легко приготовить самому. Для этого возьмите палочки диаметром 5—10 мм, длиной 100 мм (любой породы дерева), свяжите их в пучок ниткой, поместите в железную банку и засыпьте сухим речным песком. Положите банку в печку на горячие угли или на газовую плитку и прокалите, пока из банки перестанут выделяться газы. Дайте остыть песку, после чего извлеките обуглившиеся чурки — их-то и можно употребить в дело. Для получения от аккумулятора емкости в 1 ампер-час потребуется 50—90 граммов активированного угля.
Для электролита лучше всего взять дистиллированную воду, которую можно купить в аптеке, или в крайнем случае колодезную, или водопроводную, предварительно прокипятив ее около получаса и остудив. На каждый стакан воды всыпьте 1—1,5 столовой
ложки поваренной соли марки «Экстра». Заполните сосуд электролитом и накройте крышкой с электродами, проследив, чтобы электроды были полностью погружены в электролит. Простейший газовый аккумулятор готов, теперь его осталось только зарядить.
Для этого необходимо присоединить электроды к источнику постоянного тока напряжением 4,5 в. Промаркируйте какой-либо яркой краской положительный электрод, нанеся на крышку метку +. Отрицательный электрод можно не маркировать. При повторной зарядке придерживайтесь полярности электродов. Заканчивайте зарядку, когда напряжение на электродах аккумулятора будет 2,2—2,5 в. При постоянной работе аккумулятора электролит необходимо менять не реже одного раза в неделю. (Запомните, что такая частая замена нужна только для электролита, составленного на основе поваренной соли.)
Работает аккумулятор так. При зарядке, когда к электродам подключено напряжение, электролит разлагается на водород и хлор. Электрод, присоединенный к отрицательному проводу, будет поглощать водород, а к положительному — хлор. Таким образом создается разность потенциалов.
Химическая реакция может быть описана уравнением:
В качестве электролита в газовых аккумуляторах можно применять растворы различных солей, кислот и щелочей. Подбирая электролит, можно осуществить его электролиз на те или иные газы и получить различную электродвижущую силу и емкость аккумулятора. Так, при электролизе слабого раствора серной кислоты получим пару водород — кислород. Раствор питьевой соды даст пару водород — углекислый газ. Вообще подбор электролита открывает очень широкие возможности для эксперимента.
На рисунке 2 изображена схема газового аккумулятора, в котором используется пара хлор — сернистый газ. (Если вы вернетесь к нашей таблице, то увидите, что эти газы лучше остальных поглощаются углем.) Довольно высокие характеристики оправдывают конструктивное усложнение.
Аккумулятор состоит из основного сосуда 1, вспомогательного сосуда 2, вспомогательных угольных электродов 3 и 7, электролита 4, которым заполняется вспомогательный сосуд, основных угольных электродов 5 и 6, электролита 8. Размеры аккумулятора подберите, исходя из размеров угольных электродов от батарейки карманного фонаря.
В таком аккумуляторе сернистый газ — носитель отрицательного, а хлор — положительного потенциала. Электролит основного сосуда — раствор поваренной сода, электролит вспомогательного — раствор сернистого натрия (другие названия — сульфид натрия, моносульфид натрия).
Как мы сказали, вспомогательный сосуд должен быть полупроницаемым, то есть пропускать газы, но не пропускать соли, растворенные в электролите. Такой сосуд можно приобрести в магазине химических товаров или изготовить самому, причем самодельный не будет уступать промышленному. Материалы: белая глина, которая используется дляпобелки, железистосинеродистыи калий (другие названия: ферроцианид калия, желтая кровяная соль; не спутайте с железосинеродистым калием — феррицианидом калия), медный купорос. И железистосинеродистыи калий, и медный купорос можно купить в отделах фотоматериалов.
Замесите глину до пластического состояния и вылепите из нее стаканчик. Стенки стаканчика должны быть возможно тоньше. Высушите стаканчик, а потом обожгите над горячими углями до такой степени, чтобы бумага, положенная в стаканчик, обуглилась, но не вспыхнула. Лучше, если обжиг провести в муфельной печи, которые бывают в кабинетах химии. После охлаждения наполните стаканчик насыщенным раствором железистосинеродистого калия и оставьте до тех пор, пока наружные стенки его не станут влажными. Вылейте раствор (его можно использовать повторно), дайте стаканчику высохнуть, после чего опустите его на 4—5 часов в насыщенный раствор медного купороса. Растворы нужно готовить на дистиллированной, снеговой или дождевой воде. Надо брать такое количество соли, чтобы обязательно оставался нерастворимый ее остаток- это и будет насыщенный раствор.
На рисунке 3 показана схема подключения на зарядку аккумулятора с четырьмя электродами.
Схема зарядного устройства изображена на рисунке 4. Потенциометром R3 регулируется ток базы транзистора, в результате чего можно изменять величину напряжения на выходе от 0,5 до 15 В или силу тока в пределах 0—5А. Силовой трансформатор можно использовать от старого радиоприемника или телевизора. На его выходе должно быть напряжение 20 В при силе тока 6 А.
Диоды и транзистор надо монтировать на теплоотводящих панелях или радиаторах. Величины шунта R5 и добавочного сопротивления R4 можно изменять в зависимости от чувствительности и внутреннего сопротивления прибора, применяемого дли измерения величины тока и напряжения.
Зарядное устройство не требует специальной наладки и при правильной сборке готово к работе.
Предложенные нами аккумуляторы могут устанавливаться на моделях автомобилей и судов. Аккумуляторная батарея приведет в движение даже педальный автомобиль, если вы установите на нем электромотор. Но не советуем торопиться — сперва хорошенько рассчитайте (вам поможет учитель физики) параметры ваших аккумуляторов и их соответствие тому электродвигателю, который вы выберете.
И. ЧАРИЧАНСКИЙ, г. Мелитополь1974г






