Катализатор понятие: Катализатор — это… Что такое Катализатор? – Понятие о катализе и катализаторах
- 15.12.2020
Понятие о катализе и катализаторах
Одно из наиболее сильных средств влияния на скорость реакции – присутствие в реагирующей системе катализатора. Катализатором называется вещество, изменяющее скорость химической реакции, но остающееся неизменным после того, как химическая реакция заканчивается.
Катализ– явление, заключающееся в изменении скорости химической реакции под действием катализаторов. Согласно современным воззрениям, катализ обусловлен уменьшением энергии активации молекул (Ea1 ) при их контакте с катализатором (Ea2 ) так, как это показано нарис. 4.9:
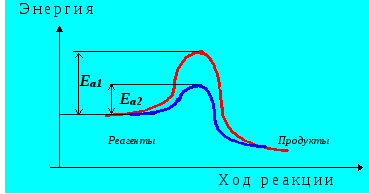
Рис. 4.9. Изменение энергии реагирующей системы в присутствии катализатора и без него.
Действие катализаторов является избирательным. Применяя разные катализаторы, можно получить из одного и того же вещества разные продукты, например:
Определенный катализатор, изменяя скорость одной реакции, совершенно не оказывает влияния на скорость другой химической реакции. Поэтому должно быть понятным, что поиски, подбор, исследование и дальнейшее внедрение в практику все новых и новых катализаторов является одной из сложнейших и важнейших задач современной химии, так как роль катализаторов в химическом производстве очень велика. Перечислим лишь несколько химических производств, где используют катализаторы.
В нефтяной промышленности для крекинга углеводородов (с помощью которого увеличивается выход бензина из керосина) и для реформинга (который приводит к перестройке структуры углеводородов и повышению октанового числа бензина).
При переработке природного газа.
При получении полимеров, искусственного каучука.
При получении серной кислоты, аммиака, синтетического метилового и этилового спиртов и т.д.
Катализ играет большую роль не только в химии, но и в биологии, так как практически все биохимические превращения, происходящие в живых организмах, являются каталитическими. В роли катализаторов в этом случае выступают ферменты – вещества биологического происхождения. Теория биохимических катализаторов – ферментов намного сложнее, чем теория химических катализаторов.
Реакционная способность веществ
Как мы уже видели, способность к взаимодействию различных химических реагентов (реакционная способность) определяется не только их атомно-молекулярной структурой, но и условиями протекания химических реакций, к которым прежде всего относятся термодинамические факторы, характеризующие зависимость реакций от температуры, давления и некоторых других условий. В еще большей степени характер и особенно скорость реакций зависят от кинетических условий, которые определяются, прежде всего, наличием катализатора.
Еще в конце XIX в. изучалось влияние растворителей на ход химических реакций. Выяснилось, что одна и та же реакция в разных растворителях протекает по-разному – с разными скоростями и выходом конечного продукта. Иногда растворитель оказывается инициатором реакции, – без него она просто не начиналась бы. В настоящее время считается общепринятым, что растворитель – непосредственный участник всякой химической реакции, является в одних случаях ее катализатором, т. е. веществом, ускоряющим реакции, а в других – ингибитором – веществом, снижающим скорость химического процесса.
Опыты показывают, что стенки реактора участвуют в химическом взаимодействии реагентов.
На интенсивность химических процессов оказывают влияние случайные примеси. Вещества различной степени чистоты проявляют себя в одних случаях как более активные реагенты, в других – как инертные. Примеси могут оказывать как каталитическое, так и ингибиторное действие. Поэтому для управления химическим процессом в реагирующие вещества вносят те или иные добавки.
Таким образом, влияние растворителей, стенок реактора и случайных примесей на ход химических реакций может быть сведено и к катализу, т. е. к положительному воздействию на химический процесс, и к ингибированию, сдерживающему процесс.
Говоря о катализаторах, следует отметить особый тип катализаторов, созданных самой природой, ферменты, или биокатализаторы. Без них возникновение и эволюция жизни на Земле были бы невозможны.
Несмотря на то, что ферменты обладают общими свойствами, присущими всем катализаторам, они не тождественны им, поскольку функционируют в рамках живых систем. Поэтому все попытки использовать опыт живой природы для ускорения химических процессов в неорганическом мире наталкиваются на серьезные ограничениями. Речь может идти только о моделировании некоторых функций ферментов и использования этих моделей для теоретического анализа деятельности живых систем, а также частично – практического применения выделенных ферментов для ускорения некоторых химических реакций.
Тот факт, что катализ играл решающую роль в переходе от химических систем к биологическим в процессе биохимической эволюции (возникновения жизни на Земле), в настоящее время подтвержден многими данными и аргументами. Наиболее убедительные результаты связаны с опытами по самоорганизации химических систем, которые наблюдали наши соотечественники Б.П. Белоусов и А.М. Жаботинский. Такие реакции сопровождаются образованием специфических пространственных и временных структур за счет поступления новых и удаления использованных реагентов. Важное значение в указанных реакциях играют каталитические процессы. Роль этих процессов усиливается по мере усложнения состава и структуры химических систем. На этом основании некоторые ученые напрямую связывают химическую эволюцию с самоорганизацией и саморазвитием каталитических систем.
Общие сведения о катализе и катализаторах
План лекции:
1 Краткая теория катализа
2 Требования, предъявляемые к катализаторам
3 Стадии каталитических реакций
4 Краткая характеристика каталитических реакций
1
Увеличение объёма производства нефтепродуктов, расширение их ассортимента и улучшение качества – основные задачи, поставленные перед нефтеперерабатывающей промышленностью в настоящее время. Возрастание доли переработки сернистых и высокосернистых нефтей, а также высокопарафинистых нефтей потребовало изменение технологии переработки нефти. Большое значение приобрели вторичные процессы. Производство топлив, отвечающих современным требованиям, невозможно без применения таких процессов как КК, КР, ГО, алкилирование, изомеризация и гидрокрекинг.
Катализ (этот термин впервые был предложен шведским химиком Берцелиусом в 1855г
Катализ – многостадийный физико-химический процесс избирательного механизма и скорости термодинамически возможных химических реакций веществом-катализатором, образующим с участниками реакций промежуточные химические соединения.
Различают положительный катализ — увеличение скорости реакции под влиянием катализатора — и отрицательный катализ, приводящий к уменьшению скорости химического превращения (ингибирование).
Следует отметить, что под термином «катализ» подразумевают преимущественно только положительный катализ.
Важной особенностью катализа является:
1) сохранение катализатором своего состава, в результате промежуточных химических взаимодействий с реагирующими веществами.
2) Катализатор не расходуется в процессе катализа. Но под влиянием реагентов, примесей, циркуляция и температура катализатора всегда претерпевает физико-химические изменения. В этой связи в промышленных каталитических процессах предусматривают операции замены, периодической или непрерывной регенерации катализатора.
3) Катализатор не может влиять на термодинамическое равновесие химической реакции.
4) специфичность действия катализатора. Многие катализаторы проявляют каталитическую активность в отношении одной или узкой группы реакции. Для каждой реакции целесообразно использовать свой наиболее активный и селективный катализатор.
Классификация катализа и каталитических реакций
По агрегатному состоянию реагирующих веществ и катализатора различают:
— гомогенный катализ, когда реагенты и катализатор находятся в одной фазе;
— гетерогенный катализ, когда каталитическая система включает несколько фаз. В нефтепереработке гетерогенный катализ, особенно с твердым катализатором, распространен значительно больше, чем гомогенный.
По природе промежуточного взаимодействия реагирующих веществ и катализаторов катализ подразделяется на три класса:
1) гомолитический катализ — когда химическое взаимодействие протекает по гомолитическому механизму.
По гомолитическому, преимущественно так называемому электронному катализу протекают реакции окислительно-восстановительного типа (такой катализ поэтому часто называют окислительно-восстановительным):
— гидрирования,
— дегидрирования,
— гидрогенолиза гетероорганических соединений нефти,
— окисления и восстановления в производстве элементной серы,
— паровой конверсии углеводородов в производстве водорода,
— гидрирования окиси углерода до метана и др.
Каталитической активностью в отношении таких реакций обладают переходные металлы первой подгруппы (Сu, Ag) и восьмой группы (Fe, Ni, Co, Pt, Pd) периодической системы Д. И. Менделеева, их окислы и сульфиды, их смеси (молибдаты никеля, кобальта, ванадаты, вольфраматы, хроматы), а также карбонилы металлов и др.
Пример: С6Н14 → С6Н12 +Н2
2) гетеролитический — в случае гетеролитической природы промежуточного взаимодействия.
Гетеролитический, или так называемый ионный, катализ, имеет место в каталитических реакциях крекинга, изомеризации, циклизации, алкилирования, деалкилирования, полимеризации углеводородов, дегидратации спиртов, гидратации олефинов, гидролиза и многих других химических и нефтехимических процессах.
К катализаторам ионных реакций относят жидкие и твердые кислоты и основания (по этому признаку гетеролитический катализ часто называют кислотно-основным): H2SO4, HF, HCl, Н3РО4, HNO3, СН3СООН, AlCl3, BF3, SbF3, окислы алюминия, циркония, алюмосиликаты, цеолиты, ионообменные смолы, щелочи и др.
Пример: RCH=CH2 + H+A— → RC+HCH3 + A—
a) RC+HCH3 → RCH2 – C+H2 – первичный карбений-ион
б) RC+HCH3 → RC+H – CH3 – вторичный карбений-ион
3) бифункциональный (сложный) катализ, включающий оба типа химического взаимодействия.
В техническом катализе (например, в процессах каталитического риформинга и гидрокрекинга) нашли широкое применение бифункциональные катализаторы, состоящие из носителя кислотного типа (окись алюминия, алюмосиликаты, промотированные галоидами, цеолитом и др.) с нанесенным на него металлом — катализатором гемолитических реакций (Pt, Pd, Co, Ni, Mo и др.)
Ценность этой классификации заключается в том, что именно природа промежуточного химического взаимодействия, а не агрегатное состояние реакционной системы определяет свойства, которыми должен обладать активный катализатор.
Пример: С6Н14 (-Н2) 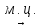 С6Н12
С6Н12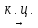 ц-С6Н12 (-3Н2)
ц-С6Н12 (-3Н2) 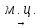 С6Н6
С6Н6
Теплота образования первичных карбений-ионов на 81 кДж/моль больше, чем для вторичных, и на 142 кДж/моль больше, чем для третичных. Вследствие этого, первичные карбений-ионы быстро переходят в третичные.
Понятие о катализаторе | Химия. Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книга
Попав на царапину или ранку, пероксид водорода разлагается намного интенсивнее (сильно пузырится, «шипит»). Кислород в момент выделения обладает сильными дезинфицирующими свойствами. Вместе с пеной из ранки удаляется загрязнение. Это происходит потому, что кровь содержит особые вещества, которые ускоряют разложение пероксида водорода. В 1835 г. шведский химик И. Берцелиус установил, что в присутствии определенных веществ скорость некоторых химических реакций существенно возрастает. Для таких веществ он ввел термин «катализатор» (греч. katalysis — «ослабление», «разрушение»).
Катализаторы — вещества, которые ускоряют химические реакции, но не входят в состав их продуктов.
Ферменты — биологические катализаторы, они ускоряют химические реакции в живых организмах.
Разложение пероксида водорода могут ускорять многие вещества. Среди них — оксид марганца (IV) — один из продуктов разложения перманганата калия. Щепотка этого соединения ускоряет разложение все новых и новых порций пероксида водорода. Сам оксид марганца (IV) при этом не расходуется и не входит в состав продуктов реакции (рис. 18.6).
| Рис. 18.5. Схема получения кислорода разложением пероксида водорода и собирания кислорода вытеснением воздуха |
| Рис. 18.6. Каталитическое разложение пероксида водорода |
Кислород немного тяжелее воздуха. Поэтому его можно собрать вытеснением воздуха в сосуд, размещенный отверстием вверх (рис. 18.5).
Катализаторы играют важную роль в жизни человека. Ферменты принимают участие в регуляции биохимических процессов. С давних времен ферментативные процессы применяют в хлебопечении, сыроварении, виноделии, пивоварении, кожевничестве и т. п.
И сейчас ферменты применяют в промышленности: при переработке сахара, получении синтетических антибиотиков и белков. В моющие средства добавляют ферменты, которые ускоряют расщепление загрязнений белковой природы. Универсальные стиральные порошки для эффективного удаления пятен от пота, крови, пищевых продуктов и других белковых загрязнений содержат биодобавки и ферменты (их еще называют «энзимы»). Материал с сайта http://worldofschool.ru
| Рис. 18.7. Изготовление сыра невозможно без применения ферментов |
| Рис. 18.8. Схема очистки автомобильных выхлопных газов |
Важная черта современной практической химии — осуществление процессов с использованием катализаторов. Без них, например, невозможно превратить растительное масло в маргарин.
Каталитические методы очищения газообразных отходов промышленных предприятий применяют для удаления разнообразных токсичных соединений.
Также катализаторы нужны для очистки автомобильных выхлопных газов (рис. 18.8).
На этой странице материал по темам:Краткий доклад катализаторы по химии
Наблюдение и эксперименты химии
Сообщение краткое о катализаторах
Реферат на тему катализаторы,понятие,их роль в жизни человека
Оціни значення каталізаторів у житті людини
Назови вещества, в которые превращаются составляющие автомобильных выхлопных газов после каталитической очистки.
Есть ли среди продуктов каталитической очистки выхлопных газов ядовитые вещества?
Оцени значение катализаторов в жизни человека.
Понятие о катализе и катализаторах
Химическая кинетика. Скорость химических реакций. Зависимость скорости реакции от природы, поверхности соприкосновения и концентрации реагирующих веществ, температуры реакции и катализаторов. Закон действующих масс для скорости химической реакции. Понятие о катализе. Катализаторы и ингибиторы. [c.26]Кислотно-основные свойства катализаторов. Сведения о кислотности часто необходимы при оценке свойств катализаторов. Активность и селективность катализаторов в реакциях крекинга органических соединений, изомеризации, полимеризации, дегидратации и других находятся в непосредственной связи с их кислотными свойствами. В настоящее время общепризнанным является принцип родственности механизмов гомогенного и гетерогенного кислотного катализа. Поэтому, по аналогии с гомогенным катализом, в гетерогенном катализе используются такие понятия, как кислота Бренстеда , кислота Льюиса и, соответственно, бренстедовские и льюисовские кислотные центры. Однако вопросы структуры кислотных точек на поверхности катализаторов, возможность перехода одного типа кислотных центров в другой, а также их влияние на поведение катализатора в процессе все еще остаются дискуссионными. [c.381]
Катализ. Основные понятия. Катализом называют явление иэменения скорости реакции или возбуждения ее, происходящее под действием некоторых веществ, называемых катализаторами, которые, участвуя в процессе, сами к концу реакций остаются химически неизменными. Как известно, влияние катализаторов может быть весьма сильным и под их действием скорости реакций могут изменяться в миллионы и большее число раз как в ту, так и в другую сторону. Под действием катализаторов могут [c.491]
Химическая кинетика. Скорость химических реакций. Факторы, влияющие на скорость химической реакции. Закон действующих масс. Физический смысл константы скорости. Правило Вант-Гоффа. Понятие об энергии активации, ее влияние на скорость химической реакции. Уравнение Аррениуса, Явление катализа. Гомогенный и гетерогенный катализ. Катализаторы, ингибиторы, промоторы, каталитические яды. Химическое равновесие. Реакции обратимые и необратимые. Состояние химического равновесия. Принцип Ле Шателье. [c.4]
Основные положения и законы химической кинетики, а также метод переходного состояния могут быть применены при описании кинетики гетерогенно-каталитических процессов. Особенность такого описания здесь заключается в известной неопределенности в понятии катализатора и химического соединения молекулы реагирующего вещества с катализатором. Если в гомогенном катализе катализатор находится в молекулярном состоянии, которое может быть строго описано термодинамическими функциями состояния А Я, 5, ДО, то в гетерогенном катализе не всегда ясно, что принимать за молекулярную единицу катализатора. Атомы и молекулы, находящиеся на поверхности раздела фаз, не тождественны атомам и молекулам, находящимся в объеме фазы. Их термодинамические функции состояния отличны от термодинамических функций молекул объемной фазы. В настоящее время нет достаточно надежных методов определения или расчета активности Д Я, 5 и ДО молекул, находящихся на границе раздела фаз. Поэтому при выражении концентрации или активности катализатора, продуктов взаимодействия молекул субстрата с катализатором приходится прибегать к условным понятиям концентрации катализатора, выражая ее через свободную, незанятую поверхность. [c.637]
Основные положения и законы химической кинетики, а также метод переходного состояния могут быть применены при описании кинетики гетерогенно-каталитических процессов. Особенность такого описания здесь заключается в известной неопределенности в понятии катализатора и Х1 мического соединения молекулы реагирующего вещества с катализатором. Если в гомогенном катализе катализатор находится в молекулярном состоянии, которое может быть строго описано термодинамическими функциями состояния 5, АО, то [c.637]
Общие понятия и определения. Явление катализа можно определить как зависимость скорости реакций от присутствия веществ — катализаторов, которые на отдельных стадиях химического процесса вступают во взаимодействие с реагирующими молекулами и резко изменяют скорость реакции, оставаясь в химически неизмененном виде. Катализатором реакции является вещество — атомы, молекулы, ионы или поверхности раздела фаз, которое взаимодействует с молекулами реагирующих веществ, изменяет скорость химической реакции и выделяется на последующих стадиях в химически неизмененном виде. Большое практическое и теоретическое значение имеют катализаторы, повышающие скорости химических реакций. Иногда нх назьшают положительными катализаторами. Катализаторы, понижающие скорость химической реакции, называют отрицательными катализаторами. Все каталитические процессы с учетом их специфичности можно разбить на три группы. [c.616]
Понятием катализ объединяются явления, иногда сильно различные по форме (механизму) действия катализаторов. [c.492]
Принятие движения атомов в молекулах гипотетично и поэтому не может быть пригодно для определения понятия катализ… Катализатором является любое вещество, которое, не появляясь в продуктах химической реакции, изменяет ее скорость . [c.10]
Данная книга построена таким образом, что ее могут использовать химики-органики в практической работе. С этой целью приводятся типичные экспериментальные методики наиболее часто применяемых МФК-реакций, а для менее важных реакций по возможности также приводятся имеющиеся данные об условиях их проведения. Поскольку эту новую область химии активно изучают в различных аспектах и поскольку многие плоды этой работы еще не собраны, то все последующее изложение представляет читателю не последнюю стадию развития данного метода, а скорее введение в него. Основные понятия МФК приводятся во введении к гл. 1. Затем излагаются общие фундаментальные данные об ионных парах и факторах, влияющих на экстракционные равновесия в системе водная фаза/органическая фаза. В гл. 2 обсуждаются различные варианты механизма МФК, включая оценку роли катализаторов и отличие межфазного катализа от мицеллярного. Основное содержание книги —гл. 3 — представляет собой изложение данных о практическом использовании МФК. Весь материал сгруппирован по типам реакций, даны обзорные таблицы и подробные методики проведения типичных, практически важных реакций. [c.10]
Ниже приводитс
