Катализатор википедия – Катализатор энергии Росси — Википедия. Что такое Катализатор энергии Росси
- 26.10.2020
Активность катализатора — Википедия
Активность катализатора, или каталитическая активность, — характеристика катализатора, выражающая его свойство ускорять химическую реакцию.[1] Чем выше активность катализатора, тем большей скорости химической реакции можно с помощью данного катализатора добиться.
Высокая активность катализатора — главное требование, предъявляемое к нему[2]. Однако активность катализатора может изменяться в результате действия множества факторов, что имеет большое практическое значение. Ниже перечислены некоторые факторы, способные влиять на каталитическую активность.
Активность зависит от количества активных компонентов в составе катализатора. Увеличение их содержания повышает количество активных центров, что влечет за собой возрастание общей активности катализатора при том, что активность каждого отдельного центра остается неизменной[3].
Активность катализаторов при гетерогенном катализе сильно зависит от размера и состояния их поверхности, поэтому во многих случаях важен способ изготовления катализатора. Так, например, медный катализатор, приготовленный путём термического разложения медных солей в неравновесных условиях, обладает существенной каталитической активностью в реакции гидратации спирта. В противоположность этому электролитическая и химически осажденная медь каталитических свойств в той же самой реакции практически не проявляет
Активность катализатора может также изменяться вследствие десорбции вещества. К примеру, наблюдалось увеличение каталитической активности цеолита при десорбции аммиака с поверхности катализатора в реакции крекинга кумола[5].
Значительный вклад в изменение каталитической активности может внести также и температура. К примеру, катализатор может быть активным в определенном температурном диапазоне и гораздо менее активным вне данных температурных пределов. Например, оптимальная активность никелевого катализатора достигается при 320°С, а при температуре более 450°С никель существенно теряет свои каталитические свойства
Активность катализатора снижается в результате процесса, который принято называть старением катализатора. Этот процесс, наиболее вероятно, идет как химически и термически, так и механически, и связан с перекристаллизацией поверхности катализатора, покрытием её пылью, оседанием на ней посторонних веществ и т. д.
Также каталитическая активность изменяется при использовании промоторов и каталитических ядов (см. ниже)
Определение активности катализатора[править | править код]
Количественно активность определяют, как разницу между скоростью реакции в данных условиях и скоростью той же реакции при отсутствии катализатора. Значение активности используют для сравнительной оценки катализаторов при их подборе, а также для характеристики качества катализатора. В зависимости от вида катализа активность обычно выражают через скорость реакции, отнесенную к единице концентрации, объёма или массы катализатора.
Гомогенный катализ[править | править код]
Гомогенным принято называть катализ, при котором катализатор и реагирующие вещества находятся в одной фазе. При гомогенном катализе для сравнения и характеристики катализатора используют скорость реакции, отнесенную к единице концентрации катализатора.[1]
Гетерогенный катализ[править | править код]
При гетерогенном катализе катализатор и реагенты находятся в разных фазах. Обычно катализатором в этом случае служит твёрдое вещество, и все реакции протекают на поверхности катализатора. В этом случае каталитическую активность считают к единице поверхности катализатора, и называют удельной активностью катализатора. На практике обычно стараются наносить катализатор на пористую поверхность, что способствует увеличению площади активной поверхности катализатора и повышает эффективность катализатора при неизменности его линейных размеров.
Активность единицы объема[править | править код]
Каталитическую активность единицы объёма катализатора можно выразить следующей формулой[9]:
W=A×S×η,
где
W — каталитическая активность единицы объёма катализатора; A — удельная активность катализатора, S — полная поверхность катализатора в единице объёма; η — степень использования катализатора.
Поверхность единицы объёма катализатора можно определить размером частиц, составляющих единичное зерно катализатора, и плотностью их размещения. Если размер частиц уменьшается, то активность единицы объёма катализатора растет только в области относительно крупных частиц. При дальнейшем уменьшении их размера на активность начинает влиять внутренняя диффузия, которая осуществляется вначале по молекулярному закону, а далее описывается законами диффузии Кнудсена.
Дальнейшее увеличение активности возможно при переходе к т. н. бидисперсным структурам, состоящим из мелких плотных частиц, соединенных в более крупные пористые частицы. Переход к бидисперсным структурам позволяет увеличить каталитическую активность в 5-8 раз[10].
Число оборотов[править | править код]
Активность катализаторов также можно охарактеризовать числом оборотов (англ. Turnover number) катализатора, который принято считать равным числу молекул реагентов, превращенных одной молекулой катализатора в секунду
Значения констант[править | править код]
Для сравнения ряда катализаторов используют также значения констант скорости реакции (при неизменности её порядка при использовании различных катализаторов) или энергию активации реакции при сохранении множителя А (характеризующего частоту соударений молекул) в уравнении Аррениуса
Основная статья: Катал
Согласно Международной системе единиц (СИ) единицей измерения активности катализатора является катал. 1 катал равен активности катализатора, при которой скорость химической реакции увеличивается на 1 моль в секунду.
Основная статья: Промоторы
Основная статья: Каталитические яды
Вещество, повышающее каталитическую активность, называют промотором. Например, каталитическая активность оксида ванадия (V) по отношению к реакции окисления диоксида серы повышается при добавлении небольших количеств сульфатов щелочных металлов
Посторонние вещества, резко снижающие активность катализатора, называют каталитическими ядами. Как правило, это вода или вредные примеси, от которых реагенты перед каталитической реакцией стремятся очистить.
- ↑ 1 2 3 4 Активность // Химик.ру — химическая энциклопедия.
- ↑ Краткая химическая энциклопедия / Кнунянц И. Л.(гл. редактор) — М: Советская Энциклопедия, 1961—1967 гг. — Т.2, С.483
- ↑ Гидрообессеривание остаточного нефтяного сырья. — Коллектив авторов. — Выпуск 17. — М.: ЦНИИТЭнефтехим.— 1978 г. — С.150.
- ↑ Голиков Г. А.— Руководство по физической химии. — М.: Высшая школа, 1983. — С.350
- ↑ Топчиева К. В., Логинов A.M., Костиков С. В. // Современные проблемы физической химии. М.: Изд-во МГУ.— Т.8 — C.24
- ↑ Вульфсон Н. С. (ред.) Препаративная органическая химия. — Перевод с польского. — М.: ГХИ, 1959.
- ↑ Бурсиан Н. Р. — Технология изомеризации парафиновых углеводородов. — Ленинград, Химия, 1985. — C.51
- ↑ Старение катализаторов // Катализ в промышленности. / Под ред. Б. Лича. — М.: Мир, 1986. — Т. 2 — C. 264—265.
- ↑ Катализаторы и каталитические процессы. — Сборник научных трудов. — Новосибирск, 1977.— С. 29—56
- ↑ Боресков Г. К. — Пористая структура катализаторов и процессы переноса в гетерогенном катализе. — Новосибирск: Наука, 1970. — с. 5-15.
- ↑ Гетерогенный катализ / Химик.ру — химическая энциклопедия.
- ↑ Швец В. Ф. — Введение в химию каталитических реакций. — Российский химико-технологический университет имени Д. И. Менделеева. — 1996.
- ↑ Reginald Garrett,Charles Grisham — Biochemistry. 5th edition — Brooks/Cole Cengage Learning. — 2009. — С.419, 444.
- ↑ Краткая химическая энциклопедия / Кнунянц И. Л.(гл. редактор) — М: Советская Энциклопедия, 1961—1967 гг. — Т.2, С.459
Катализатор Адамса — Википедия
Материал из Википедии — свободной энциклопедии
Катализатор Адамса приготавливают из хлорплатиновой кислоты H2PtCl6 или хлорплатината аммония (NH4)2PtCl6 взаимодействием с нитратом натрия. Впервые такой способ приготовления был описан в 1922 году [1]. На первой стадии образуется нитрат платины, который при нагревании разлагается
Полученную коричневую массу промывают водой для удаления следов нитратов. Катализатор может использоваться в сухом виде и храниться в эксикаторе. Платина из отработанного катализатора может быть регенерирована в исходный гексахлорплатинат аммония обработкой царской водкой и аммиаком.
Катализатор Адамса имеет несколько областей применения. Его используют для восстановления, дегидрирования и окисления. В ходе реакции образуется металлическая платина (платиновая чернь), которая является активной формой катализатора [3]. При восстановлении алкинов образуется преимущественно цис-алкен — продукт син-присоединения. Нитросоединения могут быть восстановлены до аминов, а кетоны — до спиртов. Хотя алкены восстанавливаются катализатором Адамса, при наличии в алкене нитрогруппы восстанавливается только она. Этот катализатор также используется для восстановления фенилфосфонатов, хотя на палладиевых катализаторах эта реакция не идет. Значение рН значительно влияет на направление реакции.
Катализатор Адкинса — Википедия
Материал из Википедии — свободной энциклопедии
Катализатор Адкинса — это хромит меди, комплексное неорганическое соединение состава Cu2Cr2O5, которое используется для катализа в органическом синтезе. Зачастую содержит оксид бария. Впервые был описан в 1908 г. [1] Его состав можно описать двумя химическими формулами: Cr2CuO4·CuO·BaCrO4 и Cu2Cr2O5. Последнюю форму, отравленную хинолином, часто используют для катализа реакций декарбоксилирования. Катализатор Cr2CuO4·CuO·BaCrO4 получают добавлением раствора, содержащего нитрат бария и нитрат меди (II), к раствору хромата аммония. Полученную смесь прокаливают при 350-400°C. [2]
Примеры применения в органическом синтезе[править | править код]
- Восстановление альдегидов и кетонов до соответствующих спиртов. Например, восстановление продукта, полученного ацилоиновой конденсацией себациновой кислоты, с помощью этого катализатора приводит к 1,2-циклодекандиолу. [3]
- Восстановление 2-фуриловых спиртов до 1,5-пентадиолов при 250-300°C и давлении водорода 23-41 МПа. [4]
- Декарбоксилирование α-фенилкоричной кислоты до цис-стильбена. [5]
Восстановление водородом протекает при относительно высоком давлении (около 135 атм.) и температуре (150-300°C) и носит название «гидрирующей бомбы». Более активные катализаторы, требующие менее жестких условий, как правило основаны на использовании дорогих металлов, таких как платина.
- ↑ Gröger, M. “Über Ammoniumdoppelchromate” Zeitschrift fur anorganische Chemie volume 58, page 412-426 (1908). (недоступная ссылка)
- ↑ Lazier, W. A.; H. R. Arnold, H. “Copper Chromite Catalyst” Organic Syntheses, Collected Volume 2, p. 142 (1943). Архивная копия от 9 октября 2010 на Wayback Machine
- ↑ Blomquist, A. T.; Goldstein, A. «1,2-Cyclodecanediol» Organic Syntheses Collected Volume 4, p.216. Архивная копия от 9 октября 2010 на Wayback Machine
- ↑ Kaufman, D.; Reeve, W. “1,5-Pentanediol” Organic Syntheses, Collected Volume 3, p.693 (1955). Архивная копия от 9 октября 2010 на Wayback Machine
- ↑ Buckles, R. E.; Wheeler, N. C. “cis-Stilbene” Organic Syntheses, Collected Volume 4, p.857 (1963). (недоступная ссылка)
Катализатор — Википедия
Схема протекания реакции с катализаторомКатализа́тор — химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции.
Противоположное понятие — ингибитор.
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества[1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO[1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции[2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня[2].
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.[4]
См. также
Примечания
- ↑ 1 2 Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- ↑ 1 2 Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443—1454. — ISSN 0132-344X.
- ↑ Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
- ↑ Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru. Архивировано 25 августа 2011 года.
Ссылки
Катализатор Линдлара — Википедия
Материал из Википедии — свободной энциклопедии
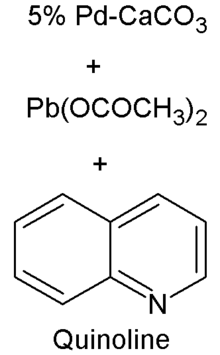 Состав катализатора Линдлара
Состав катализатора ЛиндлараКатализатор Линдлара — гетерогенный катализатор гидрирования, который применяется для селективного восстановления алкинов до (Z)-алкенов (без дальнейшего восстановления до алканов), а также для восстановления азидов и нитросоединений до аминов. Представляет собой палладий, нанесённый на карбонат кальция и отравленный какой-либо солью свинца или серой[1].
Катализатор Линдлара представляет собой тёмно-серый или чёрный порошок, содержащий 5 % палладия. Нерастворим в большинстве органических растворителей, несовместим с водой и кислотами[1].
Основной сферой применения катализатора Линдлара является селективное восстановление алкинов до (Z)-алкенов. Обычно гидрирование в таких случаях резко останавливается после поглощения алкином одного эквивалента водорода. Терминальные алкины восстанавливаются быстрее внутренних, а алкены медленнее алкинов. Сопряжённые енины восстанавливаются до сопряжённых диенов с отличной селективностью. Также хорошо восстанавливались тройные связи, сопряжённые с одной или двумя карбонильными группами[1].
Редким применением катализатора Линдлара являются реакции окисления. Так, метакролеин был окислен в его присутствии до метилметакрилата с высокой селективностью и конверсией[1].
Катализатор можно хранить в закрытой таре вдали от растворителей и отравляющих веществ (содержащих серу и фосфор). В присутствии растворителей катализатор Линдлара становится пирофорным. Суспендировать его в реакционной смеси нужно в инертной атмосфере, а при фильтрации не допускать полного высыхания осадка[1].
Катализаторы Циглера — Натта — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 февраля 2016; проверки требуют 6 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 февраля 2016; проверки требуют 6 правок.Катализаторы Циглера — Натта — катализаторы виниловой полимеризации, то есть полимеризации виниловых мономеров. Они также позволяют получать полимеры определённой тактичности (стереорегулярные полимеры). Представляют собой комплексы, образующиеся при взаимодействии соединений переходных металлов (TiCl4, TiCl3, VOCl3 и др.) с алкилами и галогеноалканами металлов II—III групп (AlR3, AlR2Cl, MgRCl, ZnR2).
В процессе полимеризации мономер координируется с алкильным производным переходного металла, а затем внедряется по связи M—C, M—M[уточнить].
По состоянию на 1990-е годы вопрос о конкретных механизмах действия катализаторов Циглера — Натты был не до конца выясненным.
В 2010 году объём производства пластмасс, эластомеров и резин с использованием катализаторов Циглера — Натты превысил 100 миллионов тонн.
В настоящее время применяется три вида катализа Циглера — Натты:
Катализаторы на основе титана были открыты и запатентованы[1] осенью 1953 года группой немецких химиков под руководством Карла Циглера (особенно значителен был вклад его ассистента Хайнца Брайля, Heinz Breil), при этом заявлялась способность осуществлять синтез высокомолекулярного полиэтилена, вскоре были поданы патенты и на синтез полимера из пропилена и α-бутилена (1-бутена (англ.)русск.). Первое время найденные соединения назывались смешанными мюльхаймскими катализаторами по месту расположения лаборатории (Мюльхайм-на-Руре), однако вскоре за ними закрепилось название катализаторов Циглера.
Для синтеза упорядоченных (стереорегулярных) полимеров, в первую очередь, α-олефинов (англ.)русск., включая тот же α-бутилен, катализаторы были использованы итальянцем Джулио Наттой,[2] дружившим и сотрудничавшим с Циглером с 1940-х годов и убедившего компанию Montecatini (англ.)русск., где Натта работал консультантом, выкупить права на использование результатов Циглера. Натта сообщил не просто о синтезе полибутилена, но и о возможности создания стереорегулярных — изотактических — полимеров. История приоритетов и патентования открытий Циглера и Натты была довольно запутанной и рассматривается как классический патентный случай[3], она привела к ссоре учёных.[4]
За эти достижения Циглеру и Натте в 1963 году была присуждена Нобелевская премия по химии.
- ↑ K. Ziegler, H. Breil, E. Holzkamp, H. Martin, Verfahren zur Herstellung von hochmolekularen Polyäthylenen, 973626 (патент заявлен 18.11.1953, получен 14.04.1960)
- ↑ G. Natta, P. Pino, P. Corradini, F. Danusso, E. Mantica, G. Mazzanti, G. Moraglio, Crystalline high polymers of α-olefins, JAMC, 77(6), 1955, pp. 1708—1710
- ↑ H. Martin, Polymers, Patents, Profits: A Classic Case Study for Patent Infighting, Wiley-VCH, 2007, ISBN 3-527-61039-1
- ↑ I. Hargittai, A. Comotti, M. Hargittai, Giulio Natta, C&EN (англ.)русск., Feb. 10, 2003, pp. 26-28
- В. А. Кабанов (гл. ред.), Энциклопедия полимеров, т.3, Советская энциклопедия, 1977, статья «Циглера — Натта катализаторы»
- Н. С. Зефиров (гл. ред.), Химическая энциклопедия, т.5, Большая Российская энциклопедия, 1998, статья «Циглера—Натты катализаторы»
- Статья «Виниловая полимеризация Циглера — Натта» на «Макрогалерее» — учебном научно-популярном сайте, разработанном Университетом Южного Миссисипи (англ.)русск.
- L. Cerruti, Historical and Philosophical Remarks on Ziegler-Natta Catalysts, HYLE — International Journal for Philosophy of Chemistry, 5(1), 1999, pp. 3-41
- G. Wilke, Fifty Years of Ziegler Catalysts: Consequences and Development of an Invention, Angewandte Chemie International Edition, 42(41), 2003, pp. 5000-5008
Обсуждение:Катализатор — Википедия
Материал из Википедии — свободной энциклопедии
Внешние воздействия нельзя относить к катализаторам:
1.Катализатор – это вещество, количество и состояние которого в ходе реакции не изменяются, см. в ВИКИ Катализ.
2. Катализатор – это вещество, изменяющее скорость реакции, но не входящее в состав продуктов (Химическая энциклопедия. Т.2, 1990, С.337).
3. Catalysis is the process in which the rate of a chemical reaction is increased by means of a chemical substance known as a catalyst. Unlike other reagents that participate in the chemical reaction, a catalyst is not consumed. Thus, the catalyst may participate in multiple chemical transformations, although in practice catalysts are sometimes consumed in secondary processes («Википедия» на английскком, статья «Catalysis»).
4. Если к катализаторам отнести внешние воздействия, ускоряющие реакцию, то катализаторами придётся считать температуру (нагрев) и перемешивание!
Про недостатки термина «Отрицательный катализ» см. в новом варианте статьи.
Наум 13:58, 11 августа 2008 (UTC)
1. Катализатор, это вещество, количество которого не изменяется в ходе реакции, а его состояние изменяется, так как происходит перегруппировка атомов и молекул на поверхности носителя катализатора. Так же может происходить вынос активных веществ с поверхности носителя в ряде последовательных реакций закоксования.
2. Катализатор не относиться к внешним воздействиям и совершенно не грамотно говорить, что «катализатор присутствует в реакционной среде» или «в присутствии катализатора», потому что это не инерт, а вещество непосредственно вступающее в реакцию.
Eenium 19:39, 24 декабря 2009 (UTC)
Если я правильно понимаю химию процесса, то в гетерогенном катализе катализатор не образует промежуточной связи, т.е. не вступает в химическую реакцию ни с одним из реагентов, но позволяет за счёт физического взаимодействия с реагентами обеспечить бОльшую интенсивность из взаимодействия между собой, таким образом катализатор не обязан проходить фазу промежуточного соединения и статья неверно сформулирована, поскольку говорит исключительно о гомогенном катализе. Frank 15:16, 20 февраля 2012 (UTC)
о термине «гомогенный катализатор»[править код]
Насколько корректно использовать термин «гомогенный катализатор»? Речь идет о катализаторе, присутствующем в гомогенной среде. Но это — гомогенный катализ, а не катализатор. Рассмотрим пример — гидрирование этилена на платине. Катализатор гомогенный — однородная платина, непрерывная пластина или проволока, а сама реакция идет в гетерогенных условиях — на границе раздела гомогенной платины и гомогенной газовой смеси. Считаю, что термин «гомогенный катализатор» надо заменить на «катализатор гомогенной реакции» (аналогично — «гетерогенный катализатор»). 194.44.31.30 13:04, 27 августа 2015 (UTC)СВК
Противоположное понятие?!![править код]
WTF?!
