Катализатор химия это: Катализатор — это… Что такое Катализатор?
- 15.10.2020
Катализатор, их виды и свойства
Катализатор, их виды и свойства.
Катализатор – это химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции, и действующее повторно (неоднократно).
Катализатор (понятие и сущность)
Типы и виды катализаторов
Свойства катализаторов
Каталитические системы на основе катализаторов
Катализатор (понятие и сущность):
Катализатор – это химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции, и действующее повторно (неоднократно).
Катализаторы – это вещества, которые ускоряют химические реакции, но не входят в состав их конечных продуктов.
Катализаторы – это вещества, ускоряющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными.
Термин катализатор (от греч. katalysis – «ослабление», «разрушение») впервые ввел в 1835 г. шведский химик И. Берцелиус, который установил, что в присутствии определенных веществ скорость некоторых химических реакций существенно возрастает.
Соответственно химические реакции, протекающие в присутствии катализаторов, именуются каталитическими реакциями. А процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами, именуется катализом.
Различают положительный катализ и отрицательный катализ. Положительным называют катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) – при котором она убывает.
Вещества, замедляющие химическую реакцию, именуются ингибиторами. Однако
Все химические реакции в присутствии катализатора протекают быстрее, поскольку катализатор снижает энергию активации реакции.
В некоторых химических реакциях катализатор реагирует с одним или несколькими реагентами с образованием временного промежуточного продукта, который затем регенерирует исходный катализатор в циклическом процессе. Химическая реакция в таких случаях состоит из нескольких стадий:
X + K → XK,
Y + XK → XYK,
XYK
KZ → K + Z,
где
X и Y – реагенты,
Z – конечный продукт химической реакции X и Y,
K – катализатор.
При этом общее уравнение реакции записывается как:
X + Y → Z.
В современном химическом производстве часто применяют каталитические системы из нескольких катализаторов, каждый из которых ускоряет разные стадии химической реакции.
Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня.
В настоящее время многие важнейшие химические производства, такие, как получение серной кислоты, аммиака, азотной кислоты, синтетического каучука, ряда полимеров и др., проводятся в присутствии катализаторов. Согласно оценкам, для производства 90 % всех коммерчески производимых химических продуктов на той или иной стадии процесса их изготовления использовались катализаторы.
Типы и виды катализаторов:
Катализаторы, как правило, подразделяются на гомогенные и гетерогенные.
Гомогенный катализатор – это катализатор, молекулы которого диспергированы (т.е. находятся) в одной и той же фазе (обычно в газообразной или жидкой), что и молекулы реагента.
Гетерогенный катализатор
Действие гомогенного катализатора, как правило, связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, что приводит к снижению энергии активации химической реакции. Впоследствии промежуточные вещества регенерируют исходный катализатор.
Гетерогенные катализаторы имеют, как правило, сильно развитую твердую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.). Их действие основано на ускорении химической реакции на своей твердой поверхности (либо на плоской открытой поверхности, либо на краях кристалла, либо вследствие сочетания этих двух факторов). Поэтому активность гетерогенного катализатора зависит от величины и свойств его поверхности.
Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Одни и те же химические реакции могут протекать как с гомогенными, так и с гетерогенными катализаторами. Для определенных химических реакций эффективны только определённые катализаторы.
В биохимических реакциях роль катализаторов выполняют ферменты, которые часто рассматриваются как третья – отдельная категория.
Соответственно классификации катализаторов положительный катализ подразделяют на три типа:
а) гомогенный катализ, когда реакционная смесь и катализатор находятся или в жидком или в газообразном состоянии;
б) гетерогенный катализ, когда катализатор находится в виде твердого вещества, а реагирующие соединения в виде раствора или газообразной смеси. Это наиболее распространенный тип катализа, осуществляемого, таким образом, на границе раздела двух фаз;
в) ферментативный катализ
Свойства катализаторов:
Катализаторы как вещества, ускоряющие химические реакции, обладают следующими свойствами:
– каталитической активностью. Каталитическая активность – это свойство катализатора ускорять химическую реакцию. Формально каталитическую активность можно определить как скорость каталитической реакции в данных условиях за вычетом скорости той же реакции в отсутствие катализатора или как соотношение скоростей каталитической и некаталитической реакций;
– селективностью. Селективность – это способность протекания химической реакции в определённом направлении, то есть свойство получать те продукты реакции, на которые направлена химическая реакция;
– неизменностью. Неизменность означает, что после участия в химической реакции они (катализаторы) остаются химически неизменными;
– активностью. Активность катализатора в процессе реакции может понижаться вследствие воздействия на катализатор вредных примесей. К последним относятся каталитические яды и ингибиторы. Каталитические яды – это вещества, вызывающие «отравление» катализатора, т. е. снижающие его каталитическую активность или полностью прекращающие каталитическое действие. Поэтому важно в процессе реакции исключить воздействие на катализатор вредных факторов.
Другими немаловажными свойствами катализаторов являются твердость, механическая прочность, устойчивость к истиранию и дроблению, срок службы, устойчивость к отравлению каталитическими ядами, размер и форма, масса единицы объема, пористость, удельная поверхность, термостойкость и стабильность.
Каталитические системы на основе катализаторов:
Современные промышленные твердые катализаторы обычно представляют собой сложные смеси, называемые контактными массами. В состав контактных масс входят прежде всего вещества, являющиеся собственно катализаторами, а также носители и активаторы.
Активаторы (промоторы) – это вещества, добавляемые к катализатору в небольших количествах с целью улучшения его свойств, таких, как активность, селективность или стабильность, которые сами по себе могут быть неактивными для данной реакции, но значительно улучшают свойства катализатора. Поэтому деление на сложные и активированные катализаторы носит лишь ориентировочный характер.
Улучшение свойств катализатора при добавлении промотора (активатора) значительно превосходит тот эффект, который можно было бы получить в результате независимого действия самого промотора, т.к. сам промотор может и не обладать каталитической активностью.
В общем случае по своему целевому назначению промоторы могут быть разделены на две группы:
– способствующие протеканию целевой реакции, т. е. увеличивающие активность катализатора;
– подавляющие нежелательные процессы, т. е. увеличивающие селективность катализатора.
Среди промоторов первой группы различают структурообразующие и активирующие. Структурообразующие промоторы, как правило, представляют собой инертные вещества, присутствующие в катализаторе в виде мелких частиц, препятствующих спеканию частиц активной каталитической фазы, что предотвращает уменьшение активной поверхности во время работы катализатора. Активирующие промоторы могут создавать дополнительные активные центры, воздействовать на электронную структуру активной фазы и т.п.
Носители – это прочные пористые термостойкие материалы, на которые осаждением, пропитыванием или другими методами наносят катализатор. При нанесении каталитических веществ на пористый носитель достигается их тонкое диспергирование, создаются большие удельные поверхности при размерах пор, близких к оптимальным, и увеличивается термостойкость катализатора, поскольку затруднено спекание его кристалликов, разобщенных на поверхности носителя. При таком методе нанесения достигается экономия дорогих катализаторов, например платины, палладия, серебра. Носитель, как правило, влияет на активность катализатора, таким образом, нет точной границы между понятием активатор и носитель. Наиболее часто в качестве носителей применяют оксид алюминия, силикагель, синтетические алюмосиликаты, каолин, пемзу, асбест, различные соли, уголь.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
Коэффициент востребованности 176
Катализ — это… Что такое Катализ?
Ката́лиз (греч. κατάλυσις восходит к καταλύειν — разрушение) — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.[1]
Термин «катализ» был введён в 1835 году шведским учёным Йёнсом Якобом Берцелиусом.
Явление катализа распространено в природе (большинство процессов, происходящих в живых организмах, являются каталитическими) и широко используется в технике (в нефтепереработке и нефтехимии, в производстве серной кислоты, аммиака, азотной кислоты и др.). Большая часть всех промышленных реакций — каталитические.
Основные принципы катализа
Катализатор изменяет механизм реакции на энергетически более выгодный, то есть снижает энергию активации. Катализатор образует с молекулой одного из реагентов промежуточное соединение, в котором ослаблены химические связи. Это облегчает его реакцию со вторым реагентом. Важно отметить, что катализаторы ускоряют обратимые реакции, как в прямом, так и в обратном направлениях.
Типы катализа
По влиянию на скорость реакции катализ многие источники делят на положительный (скорость реакции растет) и отрицательный (скорость реакции падает). В последнем случае происходит процесс ингибирования, который нельзя считать ‘отрицательным катализом’, поскольку ингибитор в ходе реакции расходуется.
Катализ бывает гомогенным и гетерогенным (контактным). В гомогенном катализе катализатор состоит в той же фазе, что и реактивы реакции, в то время, как гетерогенные катализаторы отличаются фазой.
Гомогенный катализ
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H2О2 + I → H2О + IO H2О2 + IO → H2О + О2 + IПри гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
Гетерогенный катализ
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
- Диффузия реагирующих веществ к поверхности твердого вещества
- Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
- Химическая реакция между реагирующими молекулами
- Десорбция продуктов с поверхности катализатора
- Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
Носитель катализатора
 Металлическая платина (показана стрелками), стабилизированная на носителе — оксиде алюминия
Металлическая платина (показана стрелками), стабилизированная на носителе — оксиде алюминияНоситель катализатора, иначе подложка (катализатора) (англ. carrier или support) — инертный или малоактивный материал, служащий для стабилизации на его поверхности частиц активной каталитической фазы.
Роль носителя в гетерогенном катализе состоит в предотвращении агломерации или спекания активного компонента, что позволяет поддерживать высокую площадь контакта активного вещества (см. активная каталитическая фаза) и реагентов. Количество носителя, как правило, гораздо больше количества нанесенного на него активного компонента. Основными требованиями к носителям являются большая площадь поверхности и пористость, термическая стабильность, химическая инертность, высокая механическая прочность. В ряде случаев носитель влияет на свойства активной фазы (эффект «сильного взаимодействия металл–носитель»). В качестве носителей применяют как природные (глины, пемза, диатомит, асбест и др.), так и синтетические материалы (активные угли, силикагель, алюмосиликаты, оксиды алюминия, магния, циркония и др.)[2].
Химия катализа
Химия катализа изучает вещества, изменяющие скорость химических реакций. Вещества, замедляющие реакции, называются ингибиторами. Ферменты — это биологические катализаторы. Катализатор не находится в стехиометрических отношениях с продуктами и регенерируется после каждого цикла превращения реагентов в продукты. Несмотря на появление новых способов активации молекул (плазмохимия, радиационное и лазерное воздействия и другие), катализ − основа химических производств (относительная доля каталитических процессов составляет 80-90 %).
Реакция, накормившая человечество (решение проблемы связанного азота) — цикл Габера-Боша. Аммиак получают с катализатором — пористым железом. Протекает при Р = 30 МПа и Т = 420—500 °C
3Н2 + N2 = 2NH3
Водород для синтеза NH3 получают путем двух последовательных каталитических процессов: конверсии СН4(СН4 + Н2О → СО + 3Н2) на Ni−катализаторах и конверсии образующегося оксида углерода (СО + Н2О → СО2 + Н2). Для достижения высоких степеней превращения последнюю реакцию осуществляют в две стадии: высокотемпературная (315—480 °C) — на Fe−Cr−оксидных катализаторах и низкотемпературная (200—350 °C) — на Cu−Zn−оксидных катализаторах. Из аммиака получают азотную кислоту и другие соединения азота — от лекарств и удобрений до взрывчатых веществ.
Различают катализы »гомогенный, гетерогенный, межфазный, мицеллярный, ферментативный.
Энергия активации E каталитических реакций значительно меньше, чем для той же реакций в отсутствие катализатора. Например, для некаталитического разложения NH3 на N2 + Н2 E ~ 320 кДж/моль, для того же разложения в присутствии Pt Е ~ 150 кДж/моль. Благодаря снижению E обеспечивается ускорение каталитических реакций по сравнению с некаталитическими.
Литература
- Боресков Г. К. Катализ. Вопросы теории и практики. — Новосибирск, 1987.
- Гейтс Б. Химия каталитических процессов / Б. Гейтс, Дж. Кетцир.
- Журнал «Кинетика и катализ».
- Колесников И. М. Катализ и производство катализаторов. — М.: Техника, 2004. — 399 с.
- Шуйт Г. — М.: Мир, 1981. — 551 с.
- Яблонский Г. С., Быков В. И., Горбань А. Н. Кинетические модели каталитических реакций. — Новосибирск: Наука (Сиб. отделение), 1983. — 255 c.
См. также
Ссылки
катализ — Химическая энциклопедия
КАТАЛИЗ (от греч. katalysis — разрушение)
изменение скорости хим. реакции при воздействии веществ (катализаторов), которые участвуют в реакции, но не входят в состав продуктов. Катализатор не находится в стехиометрич. отношениях с продуктами и регенерируется после каждого цикла превращ. реагентов в продукты. Различают положительный и отрицательный К., в зависимости от того, ускоряет катализатор реакцию или замедляет ее. Как правило, термин «К.» относят к ускорению реакции; вещества, замедляющие реакцию, наз. ингибиторами. Каталитич. действие на реакцию могут оказывать образующиеся в ходе реакции промежут. вещества или продукты (см. автокатализ). Для К. характерно, что небольшие количества катализатора ускоряют превращ. больших количеств реагирующих веществ. Так, 1 мас. ч. Pt-катализатора вызывает превращ. 104 мас. ч. SO3 в SO2 или 106 мас. ч. NH3 в NO. Ускоряющее действие растворителя на реакцию в растворах обычно не относят к К. на том основании, что количество растворителя, как правило, значительно превышает количество растворенных реагирующих веществ. Известны, однако, случаи ускорения реакций в присутствии очень малых добавок растворителя, напр. воды. Неизменность хим. состава и структуры катализатора по окончании процесса вряд ли может служить обязательным признаком К. Известно, что хим. состав выгруженного из реактора катализатора существенно иной, чем у загруженного; на состав и структуру катализатора влияет состав реакц. смеси.
Неизменность хим. состава и структуры катализатора имеет смысл рассматривать по отношению к той из элементарных стадий сложной каталитич. реакции, в которой непосредственно участвует катализатор, однако для этого необходимо надежно установить механизм реакции, что не всегда возможно.
Термин «К.» введен И. Берцелиусом в 1835.
При гомогенном катализе катализатор и реагирующие вещества находятся в одной фазе в молекулярно-дисперсном состоянии. При гетерогенном катализе катализатор образует самостоят. фазу, отделенную границей раздела от фазы, в которой находятся реагирующие вещества. Выделяют также гетерогенно-гомогенный К., при котором реакция начинается на поверхности твердого катализатора, а затем продолжается в объеме. Межфазным катализом принято называть К. на границе двух несмешивающихся жидкостей; при этом роль катализатора состоит в переносе реагентов между фазами. Промежут. положение между гомогенным и гетерогенным К. занимает микрогетерогенный К. коллоидными частицами в жидкой фазе. Ускорение реакций в присутствии мицелл ПАВ наз. мицеллярным катализом. Исключительную роль в процессах в живых организмах играет ферментативный катализ, обусловленный действием ферментов.
Важным компонентом пром. катализаторов являются промоторы — вещества, добавление которых к катализатору в малых количествах (проценты или доли процента) увеличивает его активность, селективность или устойчивость. Если промотор добавляется к катализатору в больших количествах или сам по себе каталитически активен, катализатор наз. смешанным. Вещества, воздействие которых на катализатор приводит к снижению его активности или полному прекращению каталитич. действия, наз. ядами каталитическими. Встречаются случаи, когда одна и та же добавка к катализатору при одних концентрациях и температурах является промотором, при других — ядом. В гетерог. К. широко применяют носители — вещества, сами по себе каталитически неактивные или малоактивные. Нанесение на них катализатора значительно повышает его активность, гл. обр. вследствие увеличения поверхности катализатора или предохранения его частиц от спекания (см. нанесенные катализаторы).
Общие закономерности катализа. Все каталитич. реакции — самопроизвольные процессы, т. е. протекают в направлении убыли энергии Гиббса системы. Катализатор не смещает положения равновесия хим. реакции, если не считать его влияния на коэф. активности реагирующих веществ в растворах (или коэф. летучести, в случае реакций в газовой фазе при высоких давлениях). Вблизи от равновесия один и тот же катализатор ускоряет прямую и обратную реакции в равной степени, вдали от равновесия этого может и не быть. Из неск. возможных реакций катализатор ускоряет не обязательно термодинамически наиб. выгодную, т. е. ту, для которой убыль энергии Гиббса максимальна. Например, в присутствии Bi2O3.MoO3 пропилен окисляется частично (до акролеина), в присутствии Co3O4 происходит полное окисление (до CO2 и H2O). Мерой селективности (избирательности действия) катализатора является отношение скорости vi реакции, ведущей к накоплению i-го продукта, к суммарной скорости превращ. исходных веществ во всех возможных реакциях, т. е. vi/Svi. Расчет скорости каталитич. реакции возможен на основе ряда моделей и приближений относительно ее механизма и режима протекания; для простейших случаев гомогенного и гетерогенного К. подход к расчету скорости изложен в ст. каталитических реакций кинетика.
Энергия активации Е каталитич. реакции значительно меньше, чем для той же реакции в отсутствие катализатора. Например, для некаталитич. разложения NH3 на N2 + H2 E ~ 320 кДж/моль, для того же разложения в присутствии Pt Е ~ 150 кДж/моль. Благодаря снижению E обеспечивается ускорение каталитич. реакций по сравнению с некаталитическими. Снижение E объясняется тем, что при К. реакция протекает по новому механизму, складывающемуся из элементарных реакций с меньшими энергиями активации, чем некаталитич. реакция. При т. наз. стадийном механизме К. (кривая 1 на рис.) реакция типа А → В (энергия активации E1) заменяется совокупностью стадий: 1) А + К → АК, 2) АК → В + К (энергии активации E2 и E3 соотв.), где К — катализатор, АК — устойчивое промежут. соед. реагента с катализатором. Для бимолекулярной реакции А + В → C + D стадийный механизм может осуществляться по схеме: 1) А + К → АК, 2) АК + B → K + C + D. По такой схеме протекает, напр., окисление H2 на металлич. катализаторе М: 1) М + 1/2O2 → МО, 2) МО + H2 → М + H2O. Одностадийные процессы К. (их наз. также ассоциативными или слитными) протекают по схеме: А + К → АК* : В + К. В этом случае (кривая 2 на рис.) катализатор не образует устойчивых промежут. соед. с реагентами, но входит в активир. комплекс АК*. Реакция происходит с преодолением одного потенциального барьера, разделяющего начальное и конечное состояния системы, как и некаталитич. реакция, но с пониженным значением энергии активации (E4 на рис.).

Энергетическая диаграмма реакции типа A → B; а — без катализатора, б — с катализатором К; 1 — при сталийном механизме, 2 — при ассоциативном механизме катализа: E1, E2, E4, E4 — потенциальные барьеры, разделяющие исходное и конечное состояния системы, Q — тепловой эффект реакции.
Большая скорость каталитич. реакции м. б. обусловлена не только снижением энергии активации вследствие протекания реакции по новому механизму, но и осуществлением под действием катализатора цепного механизма реакции. Например, каталитич. действие паров воды на газофазное окисление CO объясняется образованием реакц. цепей с участием активных частиц Н и ОН. В гетерогенно-гомог. К. на поверхности образуются активные частицы (напр., своб. радикалы HO2 и RO2 при окислении углеводородов RH), которые затем вылетают в газовую фазу и продолжают там цепь.
Доказано образование цепей на поверхности катализатора при полимеризации олефинов и синтезе углеводородов из CO и H2. Для мн. других гетерогенно-каталитич. реакций обнаружены особенности, характерные для цепных реакций: генерирование активных центров (чередование заполнения мест на поверхности и их освобождение), образование активных промежут. частиц в сверхравновесных концентрациях (что способствует преодолению барьера энергетически невыгодных стадий), достижение макс. скорости реакции спустя некоторое время после ее начала. Каталитич. и цепные реакции сближает также явление кинетич. сопряжения. Если превращ. катализатора при взаимодействии с реагентами сопряжены с самой каталитич. реакцией (т. е. имеют общее промежут. вещество или активир. комплекс), становится возможным образование сверхравновесных концентраций активных центров на поверхности катализатора и др. эффекты, типичные для цепных процессов.
Основные механизмы катализа. Каталитич. процессы, обусловленные переносом электрона (окисление, восстановление, гидрирование, дегидрирование, разложение нестойких кислородсодержащих соединений), относят к окислительно-восстановительному катализу. Типичными катализаторами для них являются переходные металлы и их соед.: простые оксиды (V2O5, MnO2, MoO3, Cr2O3), шпинели (Fe3O4, CuCr2O4), сульфиды (MoS2, WS2) и др.; для реакций в растворах — соли и комплексные соед. переходных металлов. Высокая каталитич. активность этих веществ объясняется тем, что атомы переходных металлов могут существовать в разл. степенях окисления, изменение которых не требует больших энергетич. затрат. В результате перенос электрона от реагента к катализатору осуществляется легче, чем в отсутствие катализатора от восстановителя к окислителю. При одноэлектронном переходе образуются своб. радикалы, далее участвующие в реакции. Например, при переходе одного электрона от активного центра молибденового катализатора к кислороду образуется ион-радикал O2, участвующий далее в каталитич. окислении (Mo5+ + O2 → Mo6+ + O2; O2 + CnHm : продукт). Существует окислительно-восстановит. К. с многоэлектронным механизмом, при котором не образуются своб. радикалы в качестве промежут. частиц. Многоэлектронные переходы между катализатором и реагирующими молекулами возможны, если в активный центр катализатора входят неск. атомов переходного металла. Например, в разложении H2O2 активны комплексные соед., содержащие 2 иона Fe3+; в восстановлении мол. азота до N2H4 — комплексные соед., содержащие 2 или более ионов V2+.
К процессам кислотно-основного катализа относятся каталитич. крекинг, гидратация, дегидратация, мн. реакции изомеризации, конденсации орг. веществ. Типичные катализаторы для этого класса процессов — вещества, способные передавать или принимать протон от реагентов или же способные к гетеролитич. взаимод. с реагентами (без разделения пары электронов). Среди этих веществ — протонные (H2SO4, CH3COOH, HF) и апротонные (BF3, AlCl3) кислоты, аморфные и кристаллич. алюмосиликаты, Al2O3, фосфаты, сульфаты. Активными центрами в них является протонный центр H+ (центр Брёнстеда ) или акцептор электронной пары, напр., атом Al (центр Льюиса). Реже применяются катализаторы основного характера (растворенные основания, твердые CaO, MgO и др.).
В случае т. наз. полифункциональных катализаторов отдельные этапы сложных каталитич. процессов окислительно-восстановительные и кислотно-основные — протекают на разных составных частях многокомпонентной многофазной системы. Например, при неполном окислении непредельных альдегидов в непредельные кислоты в присутствии оксидов Mo и V в элементарном акте происходят окислительно-восстановит. превращения катализатора:
V2O5 + CH2=CHCHO → CH2=CHCOOH + V2O4;
2MoO3 + CH2=CHCHO → CH2=CHCOOH + Mo2O5;
V2O4 + 1/2 O2 → V2O5, Mo2O5 + V2 O2 → 2MoO3
Конечная стадия реакций — десорбция кислоты — происходит на поверхностях V2O5 и MoO3, обладающих слабокислотными свойствами. В водных растворах каталитич. активность солей или комплексных соед. переходных металлов проявляется в определенном интервале pH. Это объясняется не только устойчивостью комплексных соед. при определенном pH, но и участием ионов H+ и OH− в элементарных стадиях К.
Катализ в промышленности. Несмотря на появление новых способов активации молекул (плазмохимия, радиац. химия, лазерная химия и др.), К. остается основой хим. производств. Относит. доля каталитич. процессов составляет 80–90% и продолжает возрастать; в общем объеме мирового пром. производства каталитич. процессы дают ок. 18% стоимости всей продукции. В неорганическом синтезе важнейшими каталитич. процессами являются производство H2SO4, синтез NH3 из N2 и H2, производство HNO3. В старейшем газофазном (нитрозном) способе производства H2SO4 окисление SO2 в SO3 осуществлялось в присутствии оксидов азота. В кон. 19 в. возник контактный процесс, при котором окисление SO2 в SO3 протекало в присутствии Pt, нанесенной на разл. носители. Впоследствии Pt была заменена V2O5 с добавкой K2O и др. оксидов. Контактным способом получают десятки млн. т H2SO4 ежегодно.
Пром. синтез NH3 из N2 и H2 был осуществлен в результате работ Ф. Габера и К. Боша в нач. 20 в. на железных катализаторах при давлениях ок. 300 атм и температуре 450–500 °C. В настоящее время используют более активные Fe-катализаторы, промотированные V2O5, CaO, Al2O3 и др. оксидами, что позволяет вести процесс при более низких давлениях и температурах. Водород для синтеза NH3 получают путем двух последоват. каталитич. процессов: конверсии CH4 или др. углеводородов (CH4 + H2O → CO + 3H2) на Ni-катализаторах и конверсии образующегося оксида углерода (CO + H2O → CO2 + H2). Для достижения высоких степеней превращения последнюю реакцию осуществляют в две стадии: высокотемпературной (315–480 °C) — на Fe-Cr-оксидных катализаторах и низкотемпературной (200–350 °C) — на Cu-Zn-оксидных катализаторах. Наиб. крупный потребитель NH3 — производство HNO3 окислением NH3 до NO на Pt и Pt-Rh сетках при 900–950 °C.
В органическом синтезе широкое применение К. началось в 1-й трети 20 в. благодаря работам П. Сабатье, В. Н. Ипатьева, Н. Д. Зелинского и др. Многочисл. реакции гидрирования C=C, C≡C, C=O, NO2-групп протекают на Ni-катализаторах, в числе которых Ni на носителях (кизельзуре, Al2O3) и скелетный Ni — высокопористый катализатор, получаемый выщелачиванием Ni-Al сплавов. Реже применяют Cu, Со, Pt, Pd. К крупным пром. процессам относится гидрогенизация жиров, превращ. бензола в циклогексан, нитробензола в анилин. В результате работ С. В. Лебедева и его учеников было создано производство синтетич. каучука. В его основе лежало получение мономера — бутадиена из этилового спирта по реакции 2C2H5OH → C4Hб + 2H2O + H2 на смешанном оксидном катализаторе, сочетающем дегидратирующую, дегидрирующую и конденсирующую функции, необходимые для всех стадий реакции. Впоследствии мономеры в производстве синтетич. каучука — бутадиен, изопрен, стирол — стали получать каталитич. дегидрированием соответствующих парафинов и олефинов на Al-Cr-оксидных катализаторах. Началось пром. применение экономически еще более выгодного процесса получения мономеров окислит. дегидрированием на разл. оксидах переходных металлов (RCH2CH3 + 1/2O2 → RCH=CH2 + H2O).
Широкое развитие в сер. 20 в. получили процессы каталитич. нефтепереработки; среди них — крекинг углеводородов нефти, для которого вначале основными катализаторами были аморфные алюмосиликаты, впоследствии цеолиты, отличающиеся более высокой активностью и большей селективностью по выходу парафиновых и ароматических углеводородов. Для получения высококачеств. бензинов, дизельных и реактивных топлив применяют каталитич. риформинг, алкилирование, гидрокрекинг и гидроочистку. Катализаторы риформинга — Al2O3, биметаллич. системы (Pt-Re на Al2O3), реже оксиды Mo или Cr на Al2O3; алкилирования — H2SO4, HF, AlCl3, BF3; гидрокрекинга (переработки высококипящих фракций нефти под давлением H2 в низкокипящие) — Al-Со-Mo- и Al-Ni-W-системы. Близкие по составу катализаторы применяют в процессах гидроочистки, в которых под давлением H2 тяжелые фракции нефти подвергаются обессериванию с выделением H2S; удаляются также азот- и кислородсодержащие соед. в результате гидрогенолиза соответствующих хим. связей. В условиях гидроочистки металлич. Ni-, Со-, Mo-, W-катализаторы превращаются в сульфиды (подробнее см. в статьях каталитический крекинг, каталитический риформинг).
Каталитич. переработка угля в моторное топливо началась в 20-30-х гг. 20 в. в двух вариантах: прямая гидрогенизация угольной пасты и синтез углеводородов по Фишеру-Тропшу на Co- и Fe-содержащих катализаторах. После 2-й мировой войны в связи с быстрым развитием нефтепереработки эти процессы утратили свое значение, однако затем интерес к каталитич. переработке угля возобновился в связи с начавшимся истощением запасов нефти. Появились новые катализаторы, были созданы опытно-пром. и отдельные пром. установки. Наиб. перспективен т. наз. Мобил-процесс, включающий газификацию угля, синтез метанола и послед. превращ. его в смесь углеводородов с большим выходом ароматических углеводородов C8-C12 на высококремнистых цеолитах с сечением пор, приближающимся к поперечному размеру соответствующих ароматич. молекул.
К наиб. крупнотоннажным процессам каталитич. окисления относятся: окисление этилена в этиленоксид на серебряных катализаторах, окисление метанола в формальдегид на серебре или молибдате Fe, окисление пропилена в акролеин и окислит. аммонолиз пропилена с получением акрилонитрила на молибдате Bi. Высокая селективность последних двух процессов достигается за счет введения в катализатор оксидных добавок; применяют шести- и даже восьмикомпонентные оксидные катализаторы. Из гомог. жидкофазных процессов в промышленности применяют окисление этилена в ацетальдегид в водном растворе, содержащем соли Cu и Pd, получение винилацетата окислением смеси C2H4 и CH3COOH в присутствии аналогичного катализатора и др. Каталитич. полимеризация получила развитие после открытия в 50-х гг. 20 в. К. Циглером и Дж. Наттой стереоспецифич. полимеризации олефинов на галогенидах, оксидах и др. соед. металлов IV-VIII групп (Ti, Zr, V, Cr, Mo и др.) с сокатализаторами — металлоорг. соед. Al и некоторых др. металлов I-III групп. В этих процессах получают кристаллич. полиолефины с регулярной структурой — полиэтилен, полипропилен, полибутадиен и др. (подробнее см. в статьях катализаторы окисления, катализаторы полимеризации, катализаторы процессов нефтепереработки).
Каталитич. синтезы на основе CO быстро развиваются в связи с возрастающим значением ненефтяного сырья. Разработан пром. процесс получения уксусной кислоты карбонилированием метанола в присутствии очень малых количеств солей Rh. Быстро возрастает применение К. для очистки отходящих пром. газов доокислением вредных орг. примесей в CO2 на катализаторах глубокого окисления: металлах, простых оксидах (MnO2, Fe2O3), шпинелях (CuCr2O4, CoCr2O4) и др. Перспективна также разработка катализаторов, селективно удаляющих вредные серосодержащие примеси (H2S, SO2) из отходящих пром. газов и прир. газа. В 70-х гг. 20 в. возникло новое направление каталитич. очистки — удаление примесей из выхлопных газов автомобилей. Катализатор в дожигателях выхлопных газов должен доокислять примеси углеводородов и CO до CO2, а также восстанавливать оксиды азота до N2. Используют в дожигателях Pt, Pd, Rh, нанесенные на носители.
Лит.: Проблемы кинетики и катализа, т. 1–19, Л.-М., 1935–85; Боресков Г. К., Катализ, ч. 1–2, Новосиб., 1971; Томас Ч., Промышленные каталитические процессы и эффективные катализаторы, пер. с англ., М.. 1973; Гейтс Б., Кетцир Дж., Шуйт Г., Химия каталитических процессов, пер. с англ., М., 1981; Крылов О. В., «Кинетика и катализ», 1985, т. 26, № 2, с. 263–74; Advances in catalysis, v. 1–35, N.Y.-L, 1948–87.
О. В. Крылов
Источник: Химическая энциклопедия на Gufo.me
Значения в других словарях
- катализ — -а, м. хим. Возбуждение химической реакции или изменение ее скорости под влиянием катализатора. [От греч. κατάλυσις — роспуск] Малый академический словарь
- катализ — катализ м. Ускорение химической реакции под влиянием некоторых веществ. Толковый словарь Ефремовой
- Катализ — • Κατάλυσις τοῦ δήμου так называлось в Афинах ниспровержение существующего строя государства в пользу какой-нибудь другой формы правления. Словарь классических древностей
- катализ — сущ., кол-во синонимов: 4 автокатализ 2 биокатализ 1 фотокатализ 1 электрокатализ 1 Словарь синонимов русского языка
- Катализ — (от греч. katálysis — разрушение) изменение скорости химических реакций в присутствии веществ (катализаторов (См. Катализаторы)), вступающих в промежуточное химическое взаимодействие с реагирующими веществами… Большая советская энциклопедия
- катализ — КАТАЛИЗ — явление самопроизвольного ускорения весьма медленно протекающих реакций. Теоретически к этой же категории должны быть отнесены все явления изменения скорости реакций в присутствии какого-либо постороннего вещества при условии… Ботаника. Словарь терминов
- катализ — орф. катализ, -а Орфографический словарь Лопатина
- КАТАЛИЗ — КАТАЛИЗ, изменение скорости протекания химической реакции посредством добавки вещества-КАТАЛИЗАТОРА, которое не участвует в реакции. Научно-технический словарь
- катализ — Катализ, катализы, катализа, катализов, катализу, катализам, катализ, катализы, катализом, катализами, катализе, катализах Грамматический словарь Зализняка
- катализ — Ката́лиз/. Морфемно-орфографический словарь
- катализ — КАТАЛИЗ а, м. catalyse f. <�гр. katalysis прекращение. Изменение скорости химической реакции под влиянием некоторых веществ (катализаторов). БАС-1. Заимствовано из фр. яз. в 1837 г. Впервые фиксируется в «Горном журнале» 1837… Словарь галлицизмов русского языка
- катализ — Катализа, м. [от греч. katalysis – роспуск] (хим.). Ускорение или замедление химической реакции под влиянием катализаторов. Большой словарь иностранных слов
- КАТАЛИЗ — КАТАЛИЗ (от греч. katalysis — разрушение) — ускорение химической реакции в присутствии веществ — катализаторов, которые взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав продуктов. Большой энциклопедический словарь
- катализ — КАТ’АЛИЗ, катализа, ·муж. (от ·греч. katalysis — роспуск) (·хим. ). Ускорение или замедление химической реакции под влиянием катализаторов. Толковый словарь Ушакова
- катализ — КАТАЛИЗ -а; м. [от греч. katalysis — роспуск, разрушение] Хим. Возбуждение химической реакции или изменение её скорости под влиянием катализатора. ◁ Каталитический, -ая, -ое. К-ая реакция. К-ая активность. Толковый словарь Кузнецова

Катализатор — Википедия. Что такое Катализатор
 Схема протекания реакции с катализатором
Схема протекания реакции с катализаторомКатализа́тор — химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции.
Противоположное понятие — ингибитор.
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества[1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO[1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции[2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня[2].
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.[4]
См. также
Примечания
- ↑ 1 2 Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- ↑ 1 2 Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443—1454. — ISSN 0132-344X.
- ↑ Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
- ↑ Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru. Архивировано 25 августа 2011 года.
Ссылки
Определение катализа. Виды катализа. Хемосорбция и образование промежуточного активированного комплекса. Энергия активации каталитической реакции. Катализ и равновесие. Применение катализа.
Катализ – явление возбуждения химических реакций специальными веществами – катализаторами. Катализатор многократно вступает в промежуточное химическое взаимодействие с веществами, участвующими в реакции и восстанавливает свой состав после каждого цикла промежуточных взаимодействий.
Гомогенный катализ – реагирующие вещества и катализатор образуют одну фазу.
Гетерогенный катализ – вещества и катализатор находятся в разных фазах.
Микрогетерогенный катализ занимает промежуточное место между гомогенным и гетерогенным катализами. Катализатор – большие полимерные молекулы. Для взаимодействующих на них небольших молекул они подобны гетерогенным частицам, но образуют с реагентами одну фазу. В эту группу входят ферментативные реакции, в которых катализатор (фермент) – крупные белковые молекулы сложного состава и строения. Поэтому его называют и ферментативным катализом.
Химическое превращение протекает через образование активного комплекса, обладающего избыточной энергией. Ее достаточно для перестройки новых веществ – продуктов реакции. Изменение энергии системы при химическом взаимодействии по реакционному пути(1).
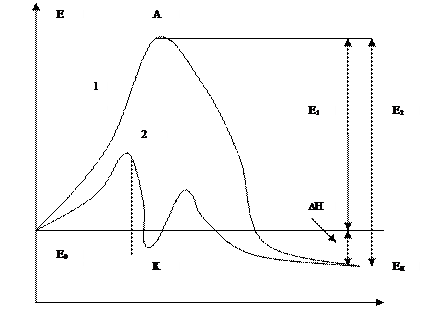
А – активированный комплекс
К –промежуточное соединение с катализатором
Е0, Ек – энергии исходных веществ и продуктов
Е1, Е2 – энергии активации превращения прямом и обратном направлениях
∆Н – изменение энергии в результате превращения (тепловой эффект).
Но не все молекулы обладают достаточной энергией для образования активного комплекса – только те, энергия которых превышает энергию активации Е1. Если необходимая энергия Е1 велика, то реакция практически не протекает.
Катализатор открывает новый реакционный путь, благодаря тому, что вступает в химическое взаимодействие с образованием активированного комплекса с меньшей энергией, чем требуется для образования активированного комплекса без катализатора. Промежуточное соединение, в которое входит катализатор, превращается далее в продукты через другой активированный комплекс, но тоже с меньшей энергией. После второго этапа реакции катализатор восстанавливает свой химический состав и его компоненты не входят в состав продуктов. И хотя реакционный путь удлиняется, становится стадийным, уменьшение энергии активированного комплекса приводит к увеличению скорости реакции (2).
Источник неизвестен
Особый интерес к катализу проявился в период развития промышленной химии, так как возможность ускорять химические реакции в нужном направлении без расхода энергии и по существу без расхода самого вещества катализатора придали катализу большую практическую значимость. С помощью катализа решаются задачи, стоящие перед технологией связанного азота, более 80% нефти перерабатывается с использованием каталитических процессов, невозможно осуществление большинства процессов органического синтеза.

Катализаторы – вещества, которые, многократно вступая в промежуточное взаимодействие с участниками реакции, изменяют ее механизм и увеличивают скорость реакции; при этом они восстанавливают свой химический состав после каждого цикла промежуточных воздействий.
Влияние катализатора на механизм химической реакции можно пояснить на условном примере. Пусть протекает одностадийная реакция с энергией активации Е0 :
А +В → R
Ход реакции на энергетической диаграмме каталитической и некаталитической реакций изображен кривой 1. В присутствии катализатора механизм реакции изменяется, она протекает через несколько последовательных стадий (кривая 2). Например, первой стадией может быть образование промежуточного активированного комплекса Акт:
А + Кт → АКт
Затем активированный комплекс реагирует со вторым реагентом с образованием комплекса катализатора и продукта:
АКт + В → RКт
Последней стадией является разложение комплекса RКт с образованием продукта К и высвобождением катализатора для нового каталитического цикла:
RКт → R +Кт
Каждая из этих последовательных стадий характеризуется своими значениями энергии активации Е1, Е2, Е3, но, как правило, высота каждого из этих потенциальных барьеров ниже энергии активации Е0. Таким образом, в присутствии катализатора реакция протекает по более энергетически выгодному пути, что позволяет проводить процесс с большей скоростью.
Исходное(I) и конечное (II) энергетические состояния реакционной системы в присутствии катализатора и без него остаются одинаковыми; следовательно: катализатор не может изменить состояние химического равновесия, которое не зависит от пути реакции.
Роль катализатора состоит лишь в изменении скорости достижения состояния равновесия. Катализатор может увеличить скорость только тех процессов, которые разрешены термодинамически, но не может инициировать термодинамически невозможные реакции.
Некоторые химические реакции без катализатора практически неосуществимы из-за слишком большой энергии активации. Казалось бы, что для преодоления высокого энергетического барьера можно повысить кинетическую энергию молекул, то есть увеличить температуру. Но для многих обратимых экзотермических реакций повышение температуры приводит к смещению равновесия в обратную сторону и делает реакцию неразрешенной термодинамически. В таких случаях применение катализаторов не только оправданно, но и необходимо. Катализатор снижает энергию активации и позволяет тем самым проводить ее при существенно более низких температурах.
Молекулы реагента адсорбируются на поверхности катализатора. Адсорбция представляет собой явление, связанное с уменьшением количества газа при соприкосновении газа (адсорбата) с твердым телом (адсорбентом), и заключается в некотором уплотнении газа на поверхности твердого тела. Различают физическую адсорбцию и хемосорбцию в зависимости от того, какова природа сил, вызывающих это концентрирование молекул адсорбата у поверхности твердого тела. Если эти силы имеют такую же природу, как и молекулярное воздействие в газах, жидкостях и твердых телах, то говорят о физической адсорбции. При хемосорбции проявляются силы взаимодействия химической природы – молекулы адсорбата теряют свою индивидуальность, образуя поверхностные соединения с адсорбентом.
При протекании каталитических процессов основная роль принадлежит хемосорбции, или активированной адсорбции, результатом которой является образование активированного комплекса адсорбции – неустойчивого промежуточного соединения между реагентом и катализатором. Стадия активированной адсорбции определяет специфичность действия катализаторов в отношении различных реакций. Если химическая связь реагента с адсорбентом слишком сильная, разрушение образования комплекса, ведущее к образованию продуктов, затрудняется. Если же связь адсорбента и адсорбата слишком слабая, близкая по своей природе к физической адсорбции, то в молекуле адсорбата не происходит разрыхления связей, приводящего к снижению энергии активации каталитического процесса по сравнению с некаталитическим.
Общая химическая технология, Кутепов А.М., Москва, Высшая школа, 1990, стр.206-207, 214, 205
катализатор | Примеры, определения и факты
Катализатор , в химии, любое вещество, которое увеличивает скорость реакции, не расходуя себя. Ферменты — это природные катализаторы, ответственные за многие важные биохимические реакции.
Полимеризация Циглера-Натта этилена Полимеризация Циглера-Натта этиленаЭтиленовый газ закачивается под давлением в реакционный сосуд, где он полимеризуется под воздействием катализатора Циглера-Натта в присутствии растворителя.Суспензия полиэтилена, непрореагировавшего этиленового мономера, катализатора и растворителя выходит из реактора. Непрореагировавший этилен отделяется и возвращается в реактор, в то время как катализатор нейтрализуется промывкой спиртом и отфильтровывается. Избыток растворителя извлекают из горячей водяной бани и рециркулируют, а сушилка обезвоживает влажный полиэтилен до его конечной порошковой формы. Encyclopædia Britannica, Inc.Подробнее на эту тему
покрытие поверхности: катализаторы и осушители
Другим ключевым компонентом покрытий, используемых при низких концентрациях, являются катализаторы и осушители, которые помогают ускорить реакции пленкообразования….
Большинство твердых катализаторов представляют собой металлы или оксиды, сульфиды и галогениды металлических элементов и полуметаллических элементов бор, алюминий и кремний. Газообразные и жидкие катализаторы обычно используются в чистом виде или в сочетании с подходящими носителями или растворителями; твердые катализаторы обычно диспергированы в других веществах, известных как носители катализаторов.
В общем, каталитическое действие представляет собой химическую реакцию между катализатором и реагентом, образуя промежуточные химические соединения, которые способны более легко реагировать друг с другом или с другим реагентом с образованием желаемого конечного продукта.Во время реакции между химическими промежуточными соединениями и реагентами катализатор регенерируется. Режимы реакций между катализаторами и реагентами широко варьируются, и в твердых катализаторах часто бывают сложными. Типичными для этих реакций являются кислотно-основные реакции, реакции окисления-восстановления, образование координационных комплексов и образование свободных радикалов. На твердых катализаторах механизм реакции сильно зависит от свойств поверхности и электронных или кристаллических структур. Некоторые твердые катализаторы, называемые полифункциональными катализаторами, способны к более чем одному способу взаимодействия с реагентами; бифункциональные катализаторы широко используются для реакций риформинга в нефтяной промышленности.
Катализированные реакции составляют основу многих промышленных химических процессов. Производство катализаторов само по себе является быстро растущим промышленным процессом.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской. Подпишитесь сегодня| процесс | катализатор |
|---|---|
| синтез аммиака | железо |
| производство серной кислоты | оксид азота (II), платина |
| крекинг нефти | цеолитов |
| гидрирование ненасыщенных углеводородов | никель, платина или палладий |
| окисление углеводородов в автомобильных выхлопах | оксид меди (II), оксид ванадия (V), платина, палладий |
| изомеризация н-бутана в изобутан | хлорид алюминия, хлористый водород |
Определение катализатора — Химический словарь
Что такое катализатор?
Катализатор — это вещество, которое ускоряет химическую реакцию, но не расходуется на реакцию; следовательно, катализатор можно извлечь химически без изменений в конце реакции, которую он использовал для ускорения, или катализировать .
Обсуждение
Чтобы химические вещества реагировали, их связи должны быть перегруппированы, поскольку связи в продуктах отличаются от связей в реагентах.Самый медленный шаг в перегруппировке связей приводит к тому, что называется переходным состоянием — химическое вещество, которое не является ни реагентом, ни продуктом, но является промежуточным звеном между ними.
Реактив⇄ Переходное состояние ⇄ Продукт
Энергия требуется для формирования переходного состояния. Эта энергия называется энергией активации , или , E , , . Чтение диаграммы ниже слева направо показывает ход реакции, когда реагенты проходят через переходное состояние, превращаясь в продукты.
Победа над барьером
Энергия активации может рассматриваться как барьер для химической реакции, препятствие, которое необходимо преодолеть. Если барьер высокий, немногие молекулы имеют достаточную кинетическую энергию для столкновения, формирования переходного состояния и пересечения барьера. Реактивы с энергией ниже, чем E a , не могут проходить через переходное состояние, чтобы реагировать и становиться продуктами.
Катализатор работает, обеспечивая другой путь реакции с более низким Е и .Катализаторы снижают энергетический барьер. Другой маршрут позволяет перегруппировке связей, необходимой для превращения реагентов в продукты, проходить легче, с меньшим потреблением энергии. В любом заданном интервале времени присутствие катализатора позволяет большей части реагентов собирать достаточную энергию для прохождения через переходное состояние и превращения в продукты.
Пример 1. Процесс Хабера
Процесс Хабера, который используется для получения аммиака из водорода и азота, катализируется железом, что обеспечивает атомные центры, на которых связи реагента могут легче перестраиваться для образования переходного состояния.
N 2 (газ) + 3H 2 (газ) N 2NH 3 (газ)
Пример 2. Ферменты
В нашем организме и других живых организмах ферменты используются для ускорения биохимических реакций. Фермент является типом катализатора.
Сложная жизнь была бы невозможна без ферментов, чтобы позволить реакциям протекать с подходящей скоростью.
Формы ферментов вместе с расположениями на ферменте, которые связываются с реагентами, обеспечивают альтернативный путь реакции, позволяя определенным молекулам объединяться, чтобы сформировать переходное состояние с пониженным барьером энергии активации.
На приведенной ниже схеме фермент с длинной цепью обеспечивает сайты для молекул реагента, которые собираются вместе, чтобы сформировать переходное состояние с низкой энергией активации.
Катализаторы не могут сместить положение химического равновесия — прямые и обратные реакции ускоряются, так что константа равновесия K eq не изменяется. Однако, удаляя продукты из реакционной смеси по мере их образования, общая скорость образования продукта на практике может быть увеличена.
,Catalyst Dx Chemistry Analyzer Ресурсы
- Соединенные Штаты Америки
- Австралия Австралия
- Австрия Австрия
- Бразилия Бразилия
- Канада Канада
- Китай Китай
- Чешский Республика Чехия
- Дания Дания
- Финляндия Финляндия
- Франция Франция
- Германия Германия
- Италия Италия
- Япония Япония
- Корея Корея
- Латинская Америка Латинская Америка
- Нидерланды Нидерланды
- Новая Зеландия Новая Зеландия
- Норвегия Норвегия
- Польша Польша
- Россия Россия
- Словакия Словакия
- Южная Африка Южная Африка
- Испания Испания
Catalyst One Ветеринарный химический анализатор
- Соединенные Штаты Америки
- Австралия Австралия
- Австрия Австрия
- Бразилия Бразилия
- Канада Канада
- Китай Китай
- Чешский Республика Чехия
- Дания Дания
- Финляндия Финляндия
- Франция Франция
- Германия Германия
- Италия Италия
- Япония Япония
- Корея Корея
- Латинская Америка Латинская Америка
- Нидерланды Нидерланды
- Новая Зеландия Новая Зеландия
