Кислота аккумуляторная формула – Электролит Кислотный Для Аккумулятора, Состав и Плотность, Корректирующий Раствор Для Свинцового АКБ, Зарядка Батареи, Изготовление Своими Руками
- 30.05.2017
Серная кислота аккумуляторная
Описание:Серная кислота — бесцветная маслянистая жидкость, не имеющая запаха. С водой и серным ангидридом смешивается в любых соотношениях с выделением большого количества тепла. Контактная серная кислота с массовой долей моногидрата 92,5-94,0% является водным раствором моногидрата (100% серной кислоты). В технике под серной кислотой подразумевают любые соединения H2SO4 с водой. Водные растворы серной кислоты характеризуются массовой долей в них H2SO4 или SO3
Серная кислота — одна из самых активных неорганических кислот. Она реагирует почти со всеми металлами и их оксидами, вступает в реакции обмена, обладает окислительными и другими важными свойствами. Основные физико-химические свойства растворов серной кислоты зависят от соотношения в ней воды и серного ангидрида (триоксида серы).
Применение:Серная кислота используется в производстве минеральных удобрений, красителей, химических волокон, а также в металлургии. Она применяется для различных технологических целей в текстильной, пищевой и др. отраслях промышленности. Аккумуляторная серная кислота применяется после разбавления ее дистиллированной водой в качестве электролита для заливки свинцовых аккумуляторов.
В качестве электролита для аккумуляторных батарей применяют раствор серной аккумуляторной кислоты в дистиллированной воде. Для различных климатических и температурных условий, в которых батарее предстоит работать, используют электролит различной плотности. Плотность электролита зависит от концентрации раствора серной аккумуляторной кислоты — чем больше концентрация раствора, тем больше плотность электролита и от температуры раствора — чем выше температура, тем ниже плотность. Концентрация или плотность электролита является точным критерием степени разряженности аккумулятора. В качестве точки отсчета, для определения текущей степени разряженности аккумулятора, принимается нормативная плотность электролита, т.е. плотность, приобретенная после первого полого заряда. Для свинцовых аккумуляторов характерно сильное разбавление электролита во время разряда из-за участия в реакции серной аккумуляторной кислоты с образованием воды. В заряженных аккумуляторах концентрация кислоты равна 30…40%. Чем меньше объем электролита, в сравнении с массой электродов, тем быстрее снижается концентрация кислоты при разряде. В конце разряда она составляет от 10 до 25%.
Серная кислота
ГОСТ 667-73
Влияние суперпластификатора и ускорителя набора прочности ПФМ-НЛК на подвижность бетонной смеси и прочностные характеристики бетона
| Технические характеристики | Высший сорт | Первый сорт |
|---|---|---|
| Массовая доля моногидрата (H2SO4), % | 92-94 | 92-94 |
| Массовая доля железа (Fe), % | 0,005 | 0,01 |
| Массовая доля остатка после прокаливания, %, не более | 0,02 | 0,03 |
| Массовая доля оксидов азота (N2O4), %, не более | 0,00003 | 0,00001 |
| Массовая доля мышьяка (As), %, не более | 0,00005 | 0,00008 |
| Массовая доля хлористых соединений (Cl), %, не более | 0,0002 | 0,0003 |
| Массовая доля марганца (Mn), %, не более | 0,00005 | 0,0001 |
| Массовая доля суммы тяжелых металлов в пересчете на свинец (Pb), %, не более | 0,01 | 0,01 |
| Массовая доля меди (Cu), %, не более | 0,0005 | 0,0005 |
| Массовая доля веществ, восстанавливающих KMnO4, см3 раствора с (1/5 KMnO4) = 0,01 моль/дм3, не более | 4,5 | 7 |
| Прозрачность | Должна выдерживать испытание по п. 3.13 | |
Техническая серная кислота и олеум (концентрированная серная кислота) должны храниться в емкостях из стали или спецстали, как нефутерованных, так и футерованных кислотоупорным кирпичом или кислотоустойчивым материалом.
Транспортировка:
Серную кислоту техническую транспортируют в железнодорожных сернокислотных цистернах в соответствии с правилами перевозок грузов. На цистерны должны быть нанесены специальные трафареты в соответствии с правилами перевозок грузов, действующими на ж.д. транспорте.
Кислота серная пожаро- и взрывобезопасна, при соприкосновении ее с водой происходит бурная реакция с большим выделением тепла, паров и газов. Токсична. По степени воздействия на организм относится к веществам 2-го класса опасности. При работе с серной кислотой обязательно применять спецодежду.
Какая кислота в аккумуляторе автомобиля
Практически все владельцы личного транспортного средства прекрасно знают о том, что в аккумуляторах есть кислота. Даже новички, которые только начинают постигать азы вождения, и то осведомлены касательно этого вопроса.
Многие из них слышали о кислотно-свинцовых аккумуляторах, но на деле так и не имеют представления, как именно работает это устройство. А между тем здесь протекают определенные химические реакции.
Какая кислота в аккумуляторе и для чего нужна
Большинство автомобилистов прекрасно знают, какая кислота залита в аккумуляторе. Но находятся и те, кто считают, что внутри аккумулятора ничего кроме дистиллированной воды (или дистиллята) нет. Другие же придерживаются мнения в пользу соляной кислоты, которое также неверно.
В любой автомобильной батарее содержится серная кислота — H2SO4. Если быть точнее, то речь идет о растворе серной кислоты с дистиллированной водой. Такая жидкость имеет общее название – электролит. Так какова роль серной кислоты?

Это основной компонент для работы АКБ. В отсутствие кислоты невозможен процесс заряда и разряда батареи. Это одна из самых активных разновидностей, которая способна вступать во взаимодействие практически с любым металлом, включая их оксиды. К тому же кислота может вступать в реакции обмена, а ее активность зависит от содержания воды.
Когда происходит заряд кислотного аккумулятора, пластины из чистого свинца (отрицательные) начинаются выделять электроны, которые принимаются решетками из оксида свинца (положительные). При разряде батареи происходит в точности до наоборот. Иными словами, когда пластины отдают электроны, они как бы «разрушаются» – происходит заряд, а при разряде они возвращаются обратно, что именуется «восстановлением».
И вот как раз для такого процесса разрушения – восстановления и нужна агрессивная среда в виде разбавленной серной кислоты. И без нее эффективность автомобильных батарей была бы на очень низком уровне.
Состав электролита и как правильно сделать
Серная кислота широко используется в современной промышленности для получения электрической энергии (аккумуляторы, батареи, электрические конденсаторы). Что касается состава электролита в АКБ, то соотношение между серной кислотой и дистиллированной водой следующее:
- сама кислота – 30%;
- дистиллированная вода – 70%.
Именно такая субстанция эффективным образом взаимодействует со свинцовыми пластинами. При этом особого внимания заслуживает плотность электролита, на что непосредственным образом оказывает влияние серная кислота. У концентрированной она достигает показателя в 1,83 г/см3. Добавлением дистиллированной воды обеспечивается понижение плотности до нужных пределов – обычно это диапазон 1,23-1,27 г/см3.
| Плотность электролита (г/см3) | Напряжение без нагрузки (В) | Напряжение с нагрузкой (В) | Степень заряженности | Замерзание электролита (С) |
|---|---|---|---|---|
| 1,27 | 12,66 | 10,8 | 100 | -60 |
| 1,26 | 12,6 | 10,66 | 94 | -55 |
| 1,25 | 12,54 | 10,5 | 87,5 | -50 |
| 1,24 | 12,48 | 10,34 | 81 | -46 |
| 1,23 | 12,42 | 10,2 | 75 | -42 |
| 1,22 | 12,36 | 10,06 | 69 | -37 |
| 1,21 | 12,3 | 9,9 | 62,5 | -32 |
| 1,2 | 12,24 | 9,74 | 56 | -27 |
| 1,19 | 12,18 | 9,6 | 50 | -24 |
| 1,18 | 12,12 | 9,46 | 44 | -18 |
| 1,17 | 12,06 | 9,3 | 37,5 | -16 |
| 1,16 | 12 | 9,14 | 31 | -14 |
| 1,15 | 11,94 | 9 | 25 | -13 |
| 1,14 | 11,88 | 8,84 | 19 | -11 |
| 1,13 | 11,82 | 8,68 | 12,56 | -9 |
| 1,12 | 11,76 | 8,54 | 6 | -8 |
| 1,11 | 11,7 | 8,4 | 0,0 | -7 |
Знать этот параметр необходимо для понимания порога замерзания электролита. При плотности в 1,11 г/см3 субстанция замерзает уже под воздействием относительно небольшого холод: -7 °C. У рекомендованных значений порог этот существенно отличен – от -58 °C до -64 °C. А можно ли самому сделать электролит?
Да, это действительно возможно, только действовать необходимо с предельной осторожностью. И поскольку предстоит иметь дело с серной кислотой высокой концентрации, то такая работа представляет определенную опасность. Необходимо позаботиться о защите рук, тела, органов дыхания.
Собственно в том, чтобы самостоятельно приготовить электролит для АКБ, нет ничего сложного – смешать серную кислоту с дистиллированной водой, соблюдая пропорцию. Стоит заметить, что обычна вода из-под крана для таких целей не подходит, поскольку содержит большое количество разных примесей, которые негативным образом воздействуют на свинцовые пластины.
Собственно сами ингредиенты:
- Серная кислота (плотность должна быть 1,83 г/см3 или более, но не менее).
- Дистиллированная вода.
- Любая фарфоровая посуда.
Пропорции кислоты и воды нам известны – 30% и 70% соответственно. При этом важен характер подхода к производству – оптимально кислоту добавлять в воду, а не наоборот. Также стоит учесть, что при их смешивании будет выделяться очень много тепловой энергии и по этой причине недопустимо использовать стеклянную посуду – она просто лопается. Когда температура электролита упадет, его можно перелить в стеклянную емкость или тару из пластика.

После того как жидкости будут соединены, следует замерить плотность ареометром. Если показатели соответствуют допустимому пределу, электролит готов к эксплуатации. Но такое приспособление имеется далеко не у каждого водителя, а поэтому пригодится следующая подсказка плотности электролита (из расчета на 1 литр дистиллированной воды):
- при 1,23г/см3 – 280г;
- при 1,25г/см3 – 310г;
- при 1,27г/см3 – 345 г;
- при 1,29г/см3 – 385 г.
Собственно на этом работа и заканчивается. Тем, кто проживает в средней полосе России, следует придерживаться плотности – 1,27 г/см3. При этом для зон с холодным климатом (до -30 °С) допустимый показатель составляет 1,26-1,28 г/см3, а жарких субтропических районов – 1,24-1,26 г/см3. Пределы плотности от 1,27 г/см3 до 1,29 г/см3 актуальны для тех регионов, где зима свирепствует до -50 °С.
К чему приведет нарушение рецептуры
Показатель в 1,29 г/см3 является не самым высоким – встречается концентрат электролита с плотностью 1,33 г/см3 (применяется для корректировки), ранее можно было найти даже с плотность 1,4 г/см3, но сейчас он снят с продажи. Однако его все же следует также разбавить водой и только после этого заливать внутрь АКБ. Почему же нельзя лить сильно концентрированный электролит?
Ничего хорошо уж точно не произойдет! Из-за высокой концентрации страдают пластины аккумулятора – их просто разъедает со временем. Это происходит медленно, но верно! Поэтому, если залить высокий концентрат, не следует удивляться тому, что АКБ в скором времени вышла из строя.

Низкая плотность электролита приводит к такому явлению, которое называется сульфатацией. Об этом процессе известно многим опытным водителям. В результате на пластинах оседают кристаллы сульфита свинца, из-за чего металл утрачивает способность к накоплению заряда.
К тому же, как выше уже было упомянуто, из-за слишком низких показателей плотности электролит замерзает, обращаясь в лед. Чем это грозит, каждому уже понятно – повреждения пластин не избежать.
Как корректировать плотность жидкости
Владельцам автомобилей необходимо контролировать уровень электролита и его плотность. Из-за гидролиза и нагрева АКБ в подкапотном пространстве содержание субстанции понижается, а плотность наоборот растет. По этой причине возникает необходимость доливать дистиллированную воду. Но иногда показатели плотности электролита могут стать меньше нормы. Тогда следует поднять концентрацию кислоты.
Существуют несколько способов как это можно сделать, исходя из степени понижения плотности электролита. Для этого следует замерить его концентрацию в каждой банке по отдельности. Если густота электролита получена от 1,18 г/см3 до 1,20 г/см3, то оптимальное решение – замена части электролита в банке на новый с плотностью 1,27 г/см3. Иными словами делается повышение плотности электролита.
Только предварительно стоит убедиться в том, что АКБ заряжена, иначе батарею следует подзарядить. При низком заряде аккумулятора к такой процедуре нельзя приступать. Иначе концентрация H2SO4 резко поднимется, что приведет только к разрушению пластин.

Сама же процедура выполняется в следующем порядке:
- Резиновой грушей откачивает как можно больше жидкости из банки. При этом замерить объем.
- Добавляют новый корректирующую жидкость с плотностью 1,27-1,29 гр/см3 в количестве равном половине изъятого объема.
- Пусть все перемешается между собой – для этого можно дать нагрузку на выводы, просто подождать некоторое время или потрясти АКБ.
- Замеряют плотность. Если показатели по-прежнему не достигли допустимых пределов доливку электролита стоит продолжать до достижения нужных параметров.
- Когда предел установлен, банки закрывают, а сам аккумулятор ставится на зарядку.
В том случае, когда плотность электролита снижена ниже уровня в 1,2 гр/см3, тогда необходимо менять его полностью – сливать старый, заливать новый.
советы по подготовке, правила эксплуатации
 Электрическая батарея автомобиля представляет собой перезаряжаемый аккумулятор, который обеспечивает электрической энергией двигатель при его запуске и позволяет функционировать всем системам транспортного средства. Работоспособность батареи определяется его выходным напряжением, которое в большей степени зависит от состава электролита для аккумуляторов.
Электрическая батарея автомобиля представляет собой перезаряжаемый аккумулятор, который обеспечивает электрической энергией двигатель при его запуске и позволяет функционировать всем системам транспортного средства. Работоспособность батареи определяется его выходным напряжением, которое в большей степени зависит от состава электролита для аккумуляторов.
Общая информация
 Аккумуляторная батарея получила такое название потому, что она состоит из нескольких ячеек, которые располагаются одна за другой в ряд. Такое устройство является последовательным соединением электрических элементов в цепи, что позволяет увеличить выходное напряжение. Каждая ячейка батареи представляет собой закрытый сосуд, в котором расположены два электрода, погруженные в специальную жидкость — электролит, представляющий собой смесь серной кислоты и дистиллированной воды. Он выступает в качестве среды, обеспечивающей ионный обмен между электродами.
Аккумуляторная батарея получила такое название потому, что она состоит из нескольких ячеек, которые располагаются одна за другой в ряд. Такое устройство является последовательным соединением электрических элементов в цепи, что позволяет увеличить выходное напряжение. Каждая ячейка батареи представляет собой закрытый сосуд, в котором расположены два электрода, погруженные в специальную жидкость — электролит, представляющий собой смесь серной кислоты и дистиллированной воды. Он выступает в качестве среды, обеспечивающей ионный обмен между электродами.
 Положительные электроды — пластины, которые состоят из пентоксида свинца, а отрицательные электроды — пластины из активного свинца. Они объединяются и группируются с помощью контактных прослоек горизонтального и вертикального типа. Такая структура обеспечивает равномерное распределение электрического тока. Объединение положительных и отрицательных свинцовых пластин называется элементом. Как правило, отрицательные пластины имеют большую толщину.
Положительные электроды — пластины, которые состоят из пентоксида свинца, а отрицательные электроды — пластины из активного свинца. Они объединяются и группируются с помощью контактных прослоек горизонтального и вертикального типа. Такая структура обеспечивает равномерное распределение электрического тока. Объединение положительных и отрицательных свинцовых пластин называется элементом. Как правило, отрицательные пластины имеют большую толщину.
Каждый элемент батареи отделяется тонкой прослойкой из пластика. Эта прослойка предотвращает возникновение короткого замыкания между рядом находящимися плюсом и минусом соседних элементов.
Между электродами и электролитом происходят электрохимические реакции, в результате которых поглощаются или выделяются электроны. Такие реакции создают разницу напряжений между электродами элемента.

На внешнюю часть корпуса аккумулятора выводятся две клеммы, с помощью которых он подсоединяется к электрической цепи. Эти клеммы расположены на верху корпуса, однако в некоторых батареях они делаются сбоку. В последнем случае возникает множество проблем, связанных с их расположением, в частности, боковые клеммы облегчают скопление паров электролита внутри батареи, что приводит к быстрому выходу из строя его рабочих элементов.
 Клемма аккумулятора является либо положительной, либо отрицательной. Положительная клемма имеет больший размер, поэтому выполнить правильную установку батареи не составит никакого труда даже новичку. Если подсоединить неправильно аккумулятор, то есть перепутать плюс и минус, тогда можно повредить всю электрическую цепь.
Клемма аккумулятора является либо положительной, либо отрицательной. Положительная клемма имеет больший размер, поэтому выполнить правильную установку батареи не составит никакого труда даже новичку. Если подсоединить неправильно аккумулятор, то есть перепутать плюс и минус, тогда можно повредить всю электрическую цепь.
Происходящие электрохимические реакции приводят к медленному износу активных элементов батареи, в частности, отрицательные электроды окисляются и становятся толще, а положительные электроды восстанавливаются и утончаются. По этой причине при покупке аккумулятора для автомобиля всегда следует обращать внимание на гарантийный срок службы устройства.
Аккумулятор может работать в ограниченном температурном диапазоне и плохо переносит низкие температуры, поэтому уход за ним состоит в периодических проверках напряжения на его клеммах и его механической целостности. Важно следить за наличием в батареи электролита для кислотных аккумуляторов и составом его.
Концентрация кислоты
 Основным компонентом электролита автомобильной аккумуляторной батареи (АКБ) является концентрированная серная кислота. Но на чистой серной кислоте устройство работать не может, поэтому в составе автомобильного электролита также присутствует дистиллированная вода. Государственный стандарт ГОСТ 667–73 регулирует качество серной кислоты, поставляемой для АКБ. Важность соблюдения этого ГОСТа связаны с резким снижением срока службы устройства в случае использования грязной серной кислоты.
Основным компонентом электролита автомобильной аккумуляторной батареи (АКБ) является концентрированная серная кислота. Но на чистой серной кислоте устройство работать не может, поэтому в составе автомобильного электролита также присутствует дистиллированная вода. Государственный стандарт ГОСТ 667–73 регулирует качество серной кислоты, поставляемой для АКБ. Важность соблюдения этого ГОСТа связаны с резким снижением срока службы устройства в случае использования грязной серной кислоты.
Плотность серной кислоты равна 1,84 г/мл, рабочее же значение плотности электролита составляет 1,3 г/мл. Следует знать, что при приготовлении электролита выделяется большое количество теплоты, поэтому не нужно забывать правило, что следует всегда лить кислоту в воду, и ни в коем случае наоборот.
Электролит, плотность которого лежит в пределе 1,07 — 1,30 г/мл, считается пригодным для работы. Этому пределу плотности соответствует концентрация h3SO4 27−40%.
Правила эксплуатации
Свойства электролита достаточно чувствительны к смене температурного режима окружающей среды, поэтому в зонах с умеренным климатом рекомендуется проверять его состояние два раза в год: в конце осени и в конце весны.
Измерение плотности
Плотность является важной характеристикой кислотного электролита, состав которого определяет ее величину. Прибор, которым измеряется плотность электролита, называется ареометром, который можно купить в любом автомагазине. При его использовании следует учитывать температуру окружающей среды и связанный с ней поправочный коэффициент.
Следующая таблица демонстрирует поправочные коэффициенты к полученным показаниям ареометра в зависимости от температуры (градусы Цельсия):
- от -40 до -26: -0,04;
- от -25 до -11: -0,03;
- от -10 до +4: -0,02;
- от +5 до +19: -0,01;
- от +20 до +30: 0,00;
- от +31 до +45: +0,01.
Помимо ареометра, для записи измеренных результатов рекомендуется заранее приготовить чистый лист бумаги и карандаш. Проверку необходимо проводить в каждом элементе батареи отдельно. Следующие шаги объясняют порядок действий:
 Первым делом следует открыть каждую емкость в батарее, плотность электролита в которой должна быть измерена.
Первым делом следует открыть каждую емкость в батарее, плотность электролита в которой должна быть измерена.- Предназначенную для измерения часть ареометра нужно поместить в электролит.
- Грушей прибора следует забрать некоторую порцию электролита так, чтобы поплавок ареометра начал плавать.
- В месте соприкосновения специального стержня и жидкости следует смотреть настоящие показания измеряемой величины.
- Полученный результат записать, а затем провести аналогичные действия для оставшихся емкостей батареи.
 Плотность является физической величиной, размерность которой определяется как г/см3. В случае электролита после проведенных измерений следует удостовериться, что ее колебания во всех элементах АКБ не превышают 0,2−0,3 г/см3. Если средняя величина плотности по всем емкостям АКБ лежит ниже установленного значения в паспорте, тогда необходимо зарядить аккумулятор.
Плотность является физической величиной, размерность которой определяется как г/см3. В случае электролита после проведенных измерений следует удостовериться, что ее колебания во всех элементах АКБ не превышают 0,2−0,3 г/см3. Если средняя величина плотности по всем емкостям АКБ лежит ниже установленного значения в паспорте, тогда необходимо зарядить аккумулятор.
При уходе за аккумулятором и контроле плотности электролита необходимо иметь в виду температурный режим. Так, в холодное время года следует поддерживать более высокие значения этой величины (1,30 г/см3), так как она обеспечивает более низкую температуру замерзания жидкости. Например, если значение плотности лежит ниже 1,1 г/см3, то в электролите могут появляться кристаллики льда уже при температуре -6 °C. Летом же лучше снижать плотность заряженной батареи до уровня 1,23 г/см3, поскольку чем она ниже, тем дольше прослужит устройство.
Зимой при низких температурах воздуха рекомендуется снимать аккумулятор с автомобиля и заносить его в помещение, в котором следует проводить все контролирующие замеры электролитических параметров. Кроме того, для эксплуатации электроприбора в северных районах страны следует приобрести специальный контейнер-рубашку, который позволяет сохранять тепло корпуса АКБ.
Уровень жидкости
 Еще одной ключевой характеристикой аккумуляторной батареи, за которой необходимо следить регулярно, является уровень электролита в каждом элементе. Согласно общим рекомендациям, он не должен быть ниже 1−1,5 см верхнего края пластин.
Еще одной ключевой характеристикой аккумуляторной батареи, за которой необходимо следить регулярно, является уровень электролита в каждом элементе. Согласно общим рекомендациям, он не должен быть ниже 1−1,5 см верхнего края пластин.
Перед измерением уровня электролита в каждой секции батареи следует поставить электроприбор на горизонтальную поверхность. После этого рекомендуется взять стеклянную трубку длиной 25−30 см и диаметром 5−6 мм, опустить ее на дно измеряемой банки, закрыть свободный конец трубочки большим пальцем, чтобы предотвратить спад жидкости в ней при вытягивании из банки, а затем вытянуть ее из электролита и любой линейкой измерить уровень.
Эту операцию можно провести с помощью обычного листа бумаги, который следует свернуть в трубочку и опустить на дно измеряемой емкости. При последующем измерении линейкой мокрого отпечатка на листе следует учесть величину погрешности, возникающую из-за капиллярного эффекта.
Если при измерениях обнаружен недостаток жидкости в какой-либо емкости батареи, тогда следует в нее добавить нужное количество дистиллированной воды.
Делать это следует осторожно, небольшими порциями, поскольку вода, попадая в кислоту, вызывает большое выделение теплоты и вскипание. Добавлять следует именно воду, а не электролит, в противном случае можно серьезно повредить электроприбор.
Подготовка электролита и батареи
Если старый аккумулятор вышел из строя и пришло время купить новый, то можно поступить двумя способами: во-первых, можно купить уже готовый залитый в АКБ электролит, во-вторых, можно приобрести сухозаправленную батарею и самостоятельно выполнить ее заливку. Первый способ рекомендуется для новичков, ко второму же методу следует прибегать, если прибор будет эксплуатироваться в каких-либо экстремальных условиях.
При подготовке раствора самостоятельно необходимо следующее:
 Канистра с дистиллятом, которая продается в каждом автомагазине, приобрести эту воду можно и в аптеке.
Канистра с дистиллятом, которая продается в каждом автомагазине, приобрести эту воду можно и в аптеке.- Серная кислота h3SO4. Рекомендуется приобретать ее в разбавленном виде, то есть с плотностью 1,40 г/см3. Реже используется концентрированная кислота с плотностью 1,84 г/см3.
- Градуированная емкость, которую можно использовать, чтобы отмерять нужные порции жидкости.
- При приготовлении электролита его нужно будет мешать, поэтому следует запастись трубкой из химически инертного материала, например, из стекла или керамики.
- Резиновые перчатки, прозрачные очки, защитный фартук, старая одежда — основные средства индивидуальной защиты.
 Во время приготовления раствора следует соблюдать элементарные правила химической безопасности, которые заключаются в добавлении воды в электролит не большими порциями, что может привести к вскипанию и разбрызгиванию во все стороны жидкости, а тонкой струей. При этом трубкой рекомендуется плавно перемешивать раствор.
Во время приготовления раствора следует соблюдать элементарные правила химической безопасности, которые заключаются в добавлении воды в электролит не большими порциями, что может привести к вскипанию и разбрызгиванию во все стороны жидкости, а тонкой струей. При этом трубкой рекомендуется плавно перемешивать раствор.
Аккумуляторный электролит нужного состава готовится согласно инструкции на упаковке путем смешивания кислоты и дистиллята. В ряде случаев их объемы смешиваются в равных количествах. После завершения процедуры надо будет замерить плотность ареометром.
В различных моделях автомобилей используют АКБ разного объема, вариации которого составляют от 2,6 до 3,7 л. В любом случае электролит можно приготовить с запасом, а оставшийся раствор необходимо нейтрализовать, бросив в него несколько ложек пищевой соды.
Как только рабочий раствор подготовлен, его нужно залить во все емкости батареи. Использовать для этого нужно либо стеклянную воронку, либо стеклянную кружку с удобным носиком. Процесс заполнения банок прибора следует проводить аккуратно и не спеша.

Заполнение производят до уровня, когда свинцовые пластины поднимаются над поверхностью электролита на 1−1,5 см. Затем прибор оставляют на 3−4 часа, при этом плотность раствора может незначительно уменьшиться.
Через несколько часов после заправки АКБ заряжают. Выполняется это так: на корпусе батареи проверяется значение емкости в Ампер-часах, это число делится на 10, и полученную величину уже используют для установления тока зарядки. Например, если емкость батареи составляет 80 А*ч, тогда ток для ее зарядки равен 8 А. Заряжать следует в течение 4 часов, после чего замеряются значения плотности и уровня электролита, и если они соответствуют рабочим величинам, тогда аккумуляторная батарея готова к использованию.
Узнаём какая кислота в аккумуляторе

Автомобильные аккумуляторы извлекают электрическую энергию из химической реакции, протекающей внутри него. по сути АКБ конвертируют энергию из электрической в химическую в процессе заряда и наоборот, когда выдают необходимый ток.
Для качественного протекания этих процессов требуются ингредиенты достаточной чистоты. Особенно это касается серной кислоты, вместе с дистиллированной водой являющейся тем, из чего состоит электролит в аккумуляторе.
Содержание статьи
Серная кислота в аккумуляторе
По сути то, что залито в аккумулятор — это разбавленная серная кислота. В основе работы любого свинцово-кислотного аккумулятора лежит химический процесс, высвобождающий электрический заряд. Молекулы серной кислоты расщепляют посредством электролитической диссоциации свинцовые электроды, создавая положительно и отрицательно заряженные ионы.
Собираясь на положительных и отрицательных электродах батареи, ионы создают на клеммах АКБ необходимый заряд. Со временем часть молекул связывается без возможности возобновить свою работу в банках, что снижает плотность электролита. Поэтому так важно следить за концентрацией аккумуляторной кислоты.
Процесс носит название электролитической диссоциации. При нём ионы с положительным зарядом(катионы) — устремляются к плюсовому электроду. К отрицательному электроду направляются анионы — отрицательно заряженные ионы.
Окислителем выступает диоксид свинца, который в результате взаимодействия с молекулами кислоты восстанавливается, отдавая отрицательный заряд на электроды. Растворы серной кислоты слабо проводят электрический ток, однако хорошо справляется с ионным обменом.
При разрядке АКБ положительные ионы свинца устремляются через электролит с губчатого свинца – восстановителя. Здесь происходит превращение в двухвалентный свинец из четырехвалентного, таким образом, оставляя заряд 2 электронов с каждого иона.
На аноде — PbO2 + SO42− + 4H+ + 2e− -> PbSO4 + 2H2O — окисление свинца.
На катоде — Pb + SO42− − 2e− ->PbSO4
Во время зарядки идут обратные реакции — свинец движется в сторону пластин.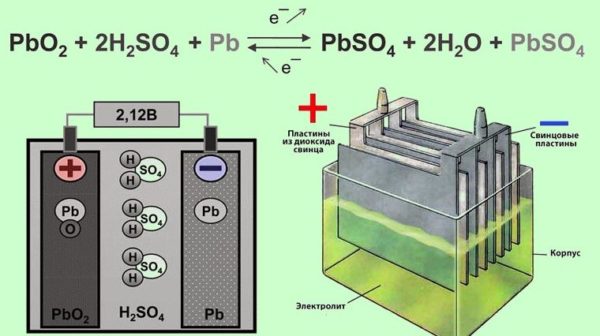
Оба электрода покрываются слоем сульфата, который образовывается из отрицательных кислотных остатков и положительных двухвалентных ионов свинца. Это называется сульфатацией, которая для пластин аккумулятора весьма опасна и грозит быстрым износом. Выделяемые газы в процессе восстановительно-окислительных реакций считаются побочным эффектом, однако они могут серьёзно повлиять на работоспособность всей батареи.
В процессе разрядки батареи к отрицательно заряженному электроду устремляются электроны, где они производят нейтрализацию ионов свинца. В зависимости от уровня заряда батареи плотность электролита может иметь разное значение.
Измерения делаются при комнатной температуре + 25 °С. Использование кислоты происходит в 1,6 раз больше положительными электродами. Поэтому рост объема электролита наблюдается при разрядке батареи и уменьшение – при зарядке.
Состав кислотного электролита
Свинцово — кислотные аккумуляторы для автомобилей наиболее распространенные на сегодня. Электролит в аккумуляторе автомобиля это 33-38 % раствор серной кислоты в дистиллированной воде. Плотность такого раствора примерно равна 1.27 г/л. Существует несколько стандартов качества кислоты, но нас интересует только характеристики кислоты для АКБ.
Согласно ГОСТ 667 73 аккумуляторная кислота должна обладать следующими физико-химическими показателями.
Для высшего сорта массовые части:
- моногидрата – 92-94 %;
- железа – до 0,005 %;
- после прокаливания остатка – 0,02 %;
- окислов азота – 0,00003 %;
- мышьяка – не более 0,00005 %;
- хлористых соединений – 0,0002 %;
- марганца – до 0,00005 %;
- всех тяжелых металлов, пересчет на Рb – 0,01 %;
- меди – 0,0005 %;
- восстановителей для KМnO – до 4,5 %.
Прозрачность раствора определяется при комнатной температуре жидкости с помощью специального теста. Согласно ГОСТ 667 73 кислота аккумуляторная должна быть определенной прозрачности, что при установке на поле с шахматными клетками и подсвечивании его электрической лампой должно давать четкие очертания ячеек. Представленные данные — это эталонные показатели, и на практике то что заливают в аккумулятор всегда ниже качеством и больше загрязнено.
Поднятие плотности в АКБ
Повышение плотности электролита происходит как следствие повышения температуры и гидролиза в батарее. Для выравнивания этого показателя требуется постоянное добавление определенного количества дистиллята. При меньшей концентрации аккумуляторной кислоты в электролите, следует ее поднимать, если датчик показывает значение ниже 1,275 г на куб. см.
Важно! Кислота является агрессивной средой для тканей человека, одежды. Поэтому при работах с открытой батареей следует позаботиться о мерах защиты: надеть защитные очки и резиновые перчатки. Не помешает прорезиненный фартук или старая одежда.
Кислотность электролита поднимается двумя путями: внесением концентрированной кислоты с помощью постепенного разбавления или полная замена электролита новым.
В первом случае следует провести такие действия для каждой банки:
- Откачать по возможности максимальное количество электролитической жидкости с помощью резиновой груши или колбы;
- Внести в банку половину ее объема электролита с плотностью от 1,275 до 1,29 г на куб. см;
- Для перемешивания электролита на выводы подается нагрузка небольшой мощности, например при подключении обычной лампочки для автомобилей, или выдерживание на протяжении нескольких часов;
- При замере плотности следует определить нужный уровень. Если не было изменений, то в половину оставшегося объема следует внести еще электролит;
- Повторное перемешивание с замером;
С помощью подобных манипуляций следует довести до нужной плотности концентрацию серной кислоты в электролите.
При показателе индикатором значения плотности ниже 1,2 г на куб. см, требуется полная замена электролитической жидкости, поскольку подобным способом поднятие ее невозможно. Такой уровень в заряженном состоянии наводит на мысль о целесообразности операции.
Если батарее менее года, то процедура может увенчаться успехом, более старые элементы питания, скорее всего, реанимацию не переживут.
Полезное видео
Видеоинструкция по обслуживанию аккумулятора
Какой электролит заливать?
Для приготовления нового электролита требуется концентрированная кислота для аккумуляторов, которая продается с плотностью 1,835 – 1,84 г на куб. см. Разбавляется жидкость чистой дистиллированной водой, поскольку содержащиеся соли металлов в обычной проточной воде пагубно влияют на электроды АКБ.
Важно! Внесение дистиллята в кислоту строго запрещено. В результате таких действий возникает сильный нагрев, бурная реакция с разбрызгиванием вещества. Поэтому добавлять следует кислоты в дистиллированную воду тонкой струйкой.
Для того чтобы развести аккумуляторную жидкость, следует проделать такие операции:
- По возможности использовать защитную одежду: защитные очки, химически устойчивую одежду и резиновые перчатки.
- Подготовить все ингредиенты и инструменты: кислоту, дистиллированную воду, ареометр, химически стойкую посуду,
- Рассчитать количество кислоты и дистиллированной воды для необходимого результата. В среднем в АКБ залито 2,6-3,7 литра раствора, но лучше разведение производить с расчетом на объем 4 литра;
- В устойчивую к кислотным воздействиям емкость наливается нужный объем дистиллята;
- Постепенно разбавляется дистиллированная вода кислотой с постоянным перемешиванием, чтобы плотные слои разводились равномерно, а не опускались на дно емкости;
- Ареометром замеряется плотность полученного раствора;
- При наличии показателя, близкого к требуемому значению, раствор должен настояться несколько часов для лучшего перемешивания.
Таблица плотностей электролита и соотношения дистиллята и кислоты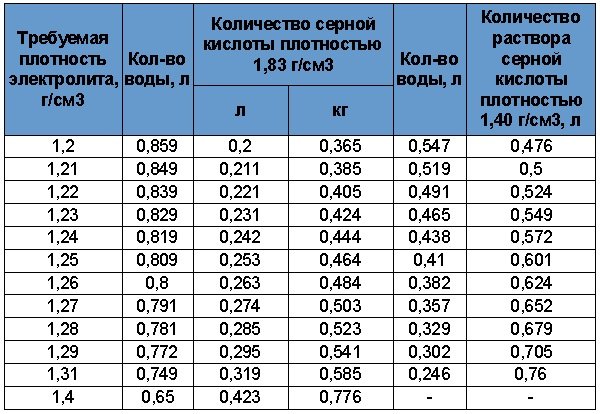
При получении слишком концентрированной жидкости, следует провести разбавление ее дистиллятом. При смешивании дистиллированной воды и аккумуляторной кислоты в процессе реакций выделяется тепло, которое будет опасным для электродов. Поэтому заливать в банки следует только остывший раствор.
Заключение
Срок службы аккумуляторной батареи ограничивается ее техническими характеристиками. Однако неправильное использование и хранение может существенно снизить этот показатель. Чтобы АКБ не изнашивалась стремительно, нужно следить за плотностью электролита и его уровнем.
В результате химических процессов повышение плотности раствора происходит из-за высокой температуры и естественных реакций окисления и восстановления. Поэтому следует доливать дистиллят. Сильное падение плотности требует полноценной замены электролитической жидкости. Важно соблюдать меры предосторожности при работе с емкостью, а также следовать четким инструкциям.
Кислота аккумуляторная формула
ГОСТ 667-73
Формула
h4SO4
Описание
Серная кислота – бесцветная маслянистая жидкость, не имеющая запаха. С водой и серным ангидридом смешивается в любых соотношениях с выделением большого количества тепла. Контактная серная кислота с массовой долей моногидрата 92,5-94,0% является водным раствором моногидрата (100% серной кислоты). В технике под серной кислотой подразумевают любые соединения h4SO4 с водой. Водные растворы серной кислоты характеризуются массовой долей в них h4SO4 или SO3.
Серная кислота – одна из самых активных неорганических кислот. Она реагирует почти со всеми металлами и их оксидами, вступает в реакции обмена, обладает окислительными и другими важными свойствами. Основные физико-химические свойства растворов серной кислоты зависят от соотношения в ней воды и серного ангидрида (триоксида серы).
Применение
Серная кислота используется в производстве минеральных удобрений, красителей, химических волокон, а также в металлургии. Она применяется для различных технологических целей в текстильной, пищевой и др. отраслях промышленности. Аккумуляторная серная кислота применяется после разбавления ее дистиллированной водой в качестве электролита для заливки свинцовых аккумуляторов.
Способ применения
В качестве электролита для аккумуляторных батарей применяют раствор серной аккумуляторной кислоты в дистиллированной воде. Для различных климатических и температурных условий, в которых батарее предстоит работать, используют электролит различной плотности. Плотность электролита зависит от концентрации раствора серной аккумуляторной кислоты – чем больше концентрация раствора, тем больше плотность электролита и от температуры раствора – чем выше температура, тем ниже плотность. Концентрация или плотность электролита является точным критерием степени разряженности аккумулятора. В качестве точки отсчета, для определения текущей степени разряженности аккумулятора, принимается нормативная плотность электролита, т.е. плотность, приобретенная после первого полного заряда. Для свинцовых аккумуляторов характерно сильное разбавление электролита во время разряда из-за участия в реакции серной аккумуляторной кислоты с образованием воды. В заряженных аккумуляторах концентрация кислоты равна 30…40%. Чем меньше объем электролита, в сравнении с массой электродов, тем быстрее снижается концентрация кислоты при разряде. В конце разряда она составляет от 10 до 25%.
Транспортировка
Серную кислоту техническую транспортируют в железнодорожных сернокислотных цистернах в соответствии с правилами перевозок грузов. На цистерны должны быть нанесены специальные трафареты в соответствии с правилами перевозок грузов, действующими на ж.д. транспорте.
Хранение
Техническая серная кислота и олеум (концентрированная серная кислота) должны храниться в емкостях из стали или спецстали, как нефутерованных, так и футерованных кислотоупорным кирпичом или кислотоустойчивым материалом. Кислота аккумуляторная должна храниться в чистых ёмкостях из
Стандарт качества
ГОСТ 667-73
Формула
H2SO4
Описание
Серная кислота – бесцветная маслянистая жидкость, не имеющая запаха. С водой и серным ангидридом смешивается в любых соотношениях с выделением большого количества тепла. Контактная серная кислота с массовой долей моногидрата 92,5-94,0% является водным раствором моногидрата (100% серной кислоты). В технике под серной кислотой подразумевают любые соединения H2SO4 с водой. Водные растворы серной кислоты характеризуются массовой долей в них H2SO4 или SO3.
Серная кислота – одна из самых активных неорганических кислот. Она реагирует почти со всеми металлами и их оксидами, вступает в реакции обмена, обладает окислительными и другими важными свойствами. Основные физико-химические свойства растворов серной кислоты зависят от соотношения в ней воды и серного ангидрида (триоксида серы).
Применение
Серная кислота используется в производстве минеральных удобрений, красителей, химических волокон, а также в металлургии. Она применяется для различных технологических целей в текстильной, пищевой и др. отраслях промышленности. Аккумуляторная серная кислота применяется после разбавления ее дистиллированной водой в качестве электролита для заливки свинцовых аккумуляторов.
Способ применения
В качестве электролита для аккумуляторных батарей применяют раствор серной аккумуляторной кислоты в дистиллированной воде. Для различных климатических и температурных условий, в которых батарее предстоит работать, используют электролит различной плотности. Плотность электролита зависит от концентрации раствора серной аккумуляторной кислоты – чем больше концентрация раствора, тем больше плотность электролита и от температуры раствора – чем выше температура, тем ниже плотность. Концентрация или плотность электролита является точным критерием степени разряженности аккумулятора. В качестве точки отсчета, для определения текущей степени разряженности аккумулятора, принимается нормативная плотность электролита, т.е. плотность, приобретенная после первого полного заряда. Для свинцовых аккумуляторов характерно сильное разбавление электролита во время разряда из-за участия в реакции серной аккумуляторной кислоты с образованием воды. В заряженных аккумуляторах концентрация кислоты равна 30…40%. Чем меньше объем электролита, в сравнении с массой электродов, тем быстрее снижается концентрация кислоты при разряде. В конце разряда она составляет от 10 до 25%.
Транспортировка
Серную кислоту техническую транспортируют в железнодорожных сернокислотных цистернах в соответствии с правилами перевозок грузов. На цистерны должны быть нанесены специальные трафареты в соответствии с правилами перевозок грузов, действующими на ж.д. транспорте.
Хранение
Техническая серная кислота и олеум (концентрированная серная кислота) должны храниться в емкостях из стали или спецстали, как нефутерованных, так и футерованных кислотоупорным кирпичом или кислотоустойчивым материалом. Кислота аккумуляторная должна храниться в чистых ёмкостях из нержавеющей стали или спецстали, а также в стеклянных бутылях, в которых она транспортировалась. При этом срок хранения продукта в закрытом складском помещении не ограничен. Допускается хранить аккумуляторную серную кислоту в емкостях с эмалированным покрытием внутренней поверхности. Не допускается хранение аккумуляторной серной кислоты в одном помещении с пищевыми продуктами.
Технические характеристики
| Серная кислота ГОСТ 667-73 | Высший сорт | Первый сорт |
| Массовая доля моногидрата (H2SO4), % | 92-94 | 92-94 |
| Массовая доля железа (Fe), % | 0,005 | 0,01 |
| Массовая доля остатка после прокаливания, %, не более | 0,02 | 0,03 |
| Массовая доля оксидов азота (N2O4), %, не более | 0,00003 | 0,00001 |
| Массовая доля мышьяка (As), %, не более | 0,00005 | 0,00008 |
| Массовая доля хлористых соединений (Cl), %, не более | 0,0002 | 0,0003 |
| Массовая доля марганца (Mn), %, не более | 0,00005 | 0,0001 |
| Массовая доля суммы тяжелых металлов в пересчете на свинец (Pb), %, не более | 0,01 | 0,01 |
| Массовая доля меди (Cu), %, не более | 0,0005 | 0,0005 |
| Массовая доля веществ, восстанавливающих KMnO4, см3 раствора с (1/5 KMnO4) = 0,01 моль/дм3, не более | 4,5 | 7 |
| Прозрачность | Должна выдерживать испытание по п. 3.13 | |
Безопасность
Кислота серная пожаро- и взрывобезопасна, при соприкосновении ее с водой происходит бурная реакция с большим выделением тепла, паров и газов. Токсична. По степени воздействия на организм относится к веществам 2-го класса опасности. При работе с серной кислотой обязательно применять спецодежду.
Свинцово-кислотный аккумулятор — Википедия
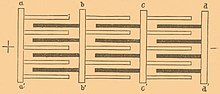
Схема свинцово-кислотного аккумулятора при зарядке (слева) и при подключении потребителя электрического тока Схема расположения электродов в свинцово-кислотном аккумуляторе, пластины катода и анода располагаются попеременно с прослойкой изолятора и объединяется каждый токонесущей полоской в выводы аккумулятора Строение свинцово-кислотного аккумулятора: слева — пластины положительного электрода, изолятора из стекловаты, отрицательного электрода; справа — аккумулятор в сборе (извлечён из корпуса с электролитом). Пластины электродов представляют собой свинцовую (чаще сплав свинца и сурьмы для повышения механической прочности[1]) решётку, ячейки которой заполнены сульфатом свинца со связующим материалом, токонесущие полосы и выводы аккумулятора изготовлены из свинца
Строение свинцово-кислотного аккумулятора: слева — пластины положительного электрода, изолятора из стекловаты, отрицательного электрода; справа — аккумулятор в сборе (извлечён из корпуса с электролитом). Пластины электродов представляют собой свинцовую (чаще сплав свинца и сурьмы для повышения механической прочности[1]) решётку, ячейки которой заполнены сульфатом свинца со связующим материалом, токонесущие полосы и выводы аккумулятора изготовлены из свинца  Варианты электрода свинцово-кислотного аккумулятора
Варианты электрода свинцово-кислотного аккумулятора  Свинцово-кислотный аккумулятор в сборе
Свинцово-кислотный аккумулятор в сбореСвинцо́во-кисло́тный аккумуля́тор — тип аккумуляторов, получивший широкое распространение ввиду умеренной цены, неплохого ресурса (от 500 циклов и более), высокой удельной мощности. Основные области применения: стартерные аккумуляторные батареи в транспортных средствах, аварийные источники электроэнергии, резервные источники энергии. Строго говоря, аккумулятором называется один элемент аккумуляторной батареи, но в просторечии «аккумулятором» называют аккумуляторную батарею (сколько бы в ней ни было элементов).
Свинцовый аккумулятор изобрёл в 1859—1860 годах Гастон Планте, сотрудник лаборатории Александра Беккереля[2]. В 1878 году Камилл Фор усовершенствовал его конструкцию, предложив покрывать пластины аккумулятора свинцовым суриком. Русский изобретатель Бенардос применил покрытие губчатым свинцом для увеличения мощности батарей, которые использовал в своих работах со сваркой.
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в водном растворе серной кислоты.
При подключении к электродам аккумулятора внешней нагрузки начинается электрохимическая реакция взаимодействия оксида свинца и серной кислоты, при этом металлический свинец окисляется до сульфата свинца (в классическом варианте аккумулятора). Проведённые в СССР исследования показали, что при разряде аккумулятора протекает как минимум ~60 различных реакций, порядка 20 из которых протекают без участия кислоты электролита[3].
Во время разряда происходит восстановление диоксида свинца на катоде[3][4] и окисление свинца на аноде. При заряде протекают обратные реакции. При перезаряде аккумулятора, после исчерпания сульфата свинца, начинается электролиз воды, при этом на аноде (положительный электрод) выделяется кислород, а на катоде — водород.
Электрохимические реакции (слева направо — при разряде, справа налево — при заряде):
- PbO2+SO42−+4H++2e−⇆PbSO4+2h3O{\displaystyle PbO_{2}+SO_{4}^{2-}+4H^{+}+2e^{-}\leftrightarrows PbSO_{4}+2H_{2}O}
- Pb+SO42−−2e−⇆PbSO4{\displaystyle Pb+SO_{4}^{2-}-2e^{-}\leftrightarrows PbSO_{4}}
При разряде аккумулятора из электролита расходуется серная кислота и выделяется относительно более лёгкая вода, плотность электролита падает. При заряде происходит обратный процесс. В конце заряда, когда количество сульфата свинца на электродах снижается ниже некоторого критического значения, начинает преобладать процесс электролиза воды. Газообразные водород и кислород выделяются из электролита в виде пузырьков — так называемое «кипение» при перезаряде. Это нежелательное явление, при заряде его следует по возможности избегать, так как при этом вода необратимо расходуется, нарастает плотность электролита и есть риск взрыва образующихся газов. Поэтому большинство зарядных устройств снижает зарядный ток при повышении напряжения аккумулятора. Потери воды восполняют доливкой в аккумуляторы дистиллированной воды при обслуживании аккумуляторной батареи (некоторые автомобильные батареи не имеют открывающихся/отвинчивающихся пробок)[5].
Элемент свинцово-кислотного аккумулятора состоит из электродов и разделительных пористых пластин, изготовленных из материала, не взаимодействующего с кислотой, препятствующих замыканию электродов (сепараторов), которые погружены в электролит. Электроды представляют собой плоские решётки из металлического свинца. В ячейки этих решёток запрессованы порошки диоксида свинца (PbO2) — в анодных пластинах и металлического свинца — в катодных пластинах. Применение порошков увеличивает поверхность раздела электролит — твердое вещество, тем самым увеличивает электрическую ёмкость аккумулятора.
Электроды вместе с сепараторами погружены в электролит, представляющий собой водный раствор серной кислоты. Для приготовления раствора кислоты применяют дистиллированную воду.
Электрическая проводимость электролита зависит от концентрации серной кислоты и при комнатной температуре максимальна при массовой доле кислоты 35%[6], что соответствует плотности электролита 1,26 г/см³[7]. Чем больше проводимость электролита, тем меньше внутреннее сопротивление аккумулятора, и, соответственно, ниже потери энергии на нём. Однако, на практике в районах с холодным климатом применяются и более высокие концентрации серной кислоты, до 1,29−1,31 г/см³, это связано с тем, что при снижении концентрации из-за разряда электролит может замёрзнуть, а при замерзании образуется лёд, который может разорвать банки аккумулятора и повреждает губчатый материал пластин.
Существуют экспериментальные разработки аккумуляторов, где свинцовые решетки заменяют пластинами из переплетённых нитей углеродного волокна, покрытых тонкой свинцовой плёнкой. При этом используется меньшее количество свинца, распределённого по большой площади, что позволяет изготовить аккумулятор не только компактным и лёгким, при прочих равных параметрах, но и значительно более эффективным — помимо большего КПД, заряжается значительно быстрее традиционных аккумуляторов[8].
В аккумуляторах, применяемых в бытовых ИБП, систем охранной сигнализации и др. жидкий электролит загущают водным щелочным раствором силикатов натрия (Na2Si2O4) до пастообразного состояния. Это так называемые гелевые аккумуляторы (GEL), имеющие длительный ресурс. Другой вариант исполнения − с пористыми сепараторами из стеклоткани (AGM), допускающими более жёсткие режимы заряда[9].
Электрические и эксплуатационные параметры[править | править код]
- Удельная предельная теоретическая энергоёмкость (Вт·ч/кг): около 133.
- Удельная энергоёмкость (Вт·ч/кг): 25—40[10].
- Теоретическая удельная энергоплотность (Вт·ч/дм³): 1250[11].
- ЭДС одного заряжённого аккумулятора = 2,11—2,17 В, рабочее напряжение 2,1 В (3 или 6 аккумуляторов в итоге дают в батарее стандартные 6,3 В или 12,6 В соответственно)[3].
- Напряжение полностью разряженного аккумулятора = 1,75—1,8 В. Ниже разряжать их нельзя[3].
- Рабочая температура: от −40 °C до +40 °C.
- КПД: порядка 80—90 % (по току). КПД по энергии 70-80%[10].
Чаще всего свинцово-кислотные аккумуляторы применяются в составе аккумуляторной батареи с номинальным напряжением 6, 12 вольт, реже с другим кратным 2 напряжением. Промышленностью выпускаются варианты обслуживаемых (заливание электролита, дистиллированной воды, контроль плотности электролита, его замена) и не обслуживаемых в герметичном корпусе (исключается проливание электролита при изменений положения, переворачиваний) аккумуляторных батарей. Обслуживаемые аккумуляторные батареи могут выпускаться сухозаряженными (без залитого электролита), что увеличивает их срок хранения и не требует периодического обслуживания при хранении, заливка производится перед вводом в эксплуатацию[12].
-

Герметичная не обслуживаемая свинцово-кислотная аккумуляторная батарея напряжением 12 В и ёмкостью 4,5 А·ч бытовой электротехники
Свинцово-кислотные аккумуляторные батареи напряжением 8 В и ёмкостью 3,5 А·ч ИБП
-

Вариант обслуживаемой свинцово-кислотной аккумуляторной батареи для автомототракторной техники в эбонитовом корпусе, в подобных батареях была даже возможность заменить отдельный вышедший из строя аккумулятор
-

Вариант не обслуживаемой свинцово-кислотной аккумуляторной батареи для автомототракторной техники, нет доступа к заливным горловинам банок аккумуляторов
- Номинальная ёмкость, показывает количество электричества, которое может отдать данный аккумулятор. Обычно указывается в ампер-часах, и измеряется при разряде малым током (1/20 номинальной ёмкости, выраженной в А·ч)[13].
- Стартерный ток (для автомобильных аккумуляторов). Характеризует способности отдавать сильные токи при низких температурах. В большинстве случаев измеряется при −18 °C (0 °F) в течение 30 секунд. Различные методики замера отличаются (главным образом, допускаемым конечным напряжением) поэтому дают различные результаты[14].
- Резервная ёмкость (для автомобильных аккумуляторов) — характеризует время, в течение которого аккумулятор может отдавать ток 25 А до конечного напряжения 10,5 В согласно ГОСТ Р 53165-2008[15].
При эксплуатации «обслуживаемых» аккумуляторов (с открываемыми пробками на банках) на автомобиле при движении по неровной дороге неизбежно происходит просачивание электролита из-под пробок на корпус аккумулятора. Через электропроводную не высыхающую, из-за гигроскопичности, плёнку электролита происходит постепенный саморазряд аккумулятора. Во избежание глубокого саморазряда необходимо периодически нейтрализовать электролит протиранием корпуса аккумулятора, например, слабым раствором пищевой соды или разведённым в воде до консистенции жидкой сметаны хозяйственным мылом. Кроме того, особенно в жаркую погоду, происходит испарение воды из электролита; также количество воды в электролите уменьшается при перезаряде аккумулятора за счёт её электролиза. Потеря воды увеличивает плотность электролита, увеличивая напряжение на аккумуляторе. При существенной потере воды могут оголиться пластины, что одновременно увеличивает саморазряд и вызывает сульфатацию батареи. Поэтому необходимо следить за уровнем электролита и при необходимости доливать дистиллированную воду.
Эти меры вместе с проверкой автомобиля на паразитную утечку тока в его электрооборудовании и периодической подзарядкой аккумулятора могут существенно продлить срок эксплуатации аккумуляторной батареи.
Работа свинцово-кислотного аккумулятора при низких температурах[править | править код]
По мере снижения окружающей температуры параметры аккумулятора ухудшаются, однако, в отличие от прочих типов аккумуляторов, у свинцово-кислотных аккумуляторов это снижение относительно мало, что и обуславливает их широкое применение на транспорте. Эмпирически считается, что свинцово-кислотный аккумулятор теряет ~1 % отдаваемой ёмкости при снижении температуры на каждый градус от +20 °C. То есть, при температуре −30 °C свинцово-кислотный аккумулятор покажет примерно 50 % ёмкости.
Снижение ёмкости и токоотдачи при низких температурах обусловлено, в первую очередь, снижением скорости химических реакций (закон Аррениуса). Единственным способом повышения отдаваемой ёмкости является подогрев холодной батареи, как вариант — встроенным подогревателем (6СТ-190ТР-Н).
Разряженный аккумулятор в мороз может раздуться из-за замерзания электролита низкой плотности (близкой к 1,10 г/см3) и образования кристаллов льда, что приводит к необратимому повреждению свинцовых пластин внутри аккумулятора.
Низкие температуры электролита негативно влияют на работоспособность и зарядно-разрядные характеристики аккумулятора[16]:
- при температуре от 0 °C до −10 °C снижение зарядных и разрядных характеристик несущественно влияют на работоспособность аккумулятора;
- при температуре от −10 °C до −20 °C происходит снижение тока в стартерном режиме и ухудшение заряда;
- при температуре ниже −20 °C аккумуляторные батареи не обеспечивают надежного пуска двигателя и не способны принимать заряд от генератора.
Из-за большего внутреннего сопротивления, присущего современным аккумуляторам закрытого типа (т. н. «необслуживаемым», герметичным, герметизированным) при низких температурах по сравнению с обычными аккумуляторами (открытого типа), для них эти вопросы ещё более актуальны[17].
Для эксплуатации транспортных средств при очень низких температурах предназначены конструкции аккумулятора с внутренним электроподогревом[18].
Хранение[править | править код]
 | Статья или раздел содержит противоречия и не может быть понята однозначно. Следует разрешить эти противоречия, используя более точные авторитетные источники или корректнее их цитируя. На странице обсуждения должны быть подробности. |
Свинцово-кислотные аккумуляторы следует хранить только в заряженном состоянии. При температуре ниже −20 °C подзаряд аккумуляторов должен проводиться постоянным напряжением 2,45 В/элемент 1 раз в год в течение 48 часов. При комнатной температуре — 1 раз в 8 месяцев постоянным напряжением 2,35 В/элемент в течение 6—12 часов. Хранение аккумуляторов при температуре выше 30 °C не рекомендуется.
Слой грязи, солей и плёнки электролита на поверхности корпуса аккумулятора создаёт проводник для тока между электродами и приводит к саморазряду аккумулятора, при глубоком разряде начинается сульфатация пластин с образованием более плотного сульфида который меньше и труднее потом вступает в реакцию , чем сульфид образующиеся при нормальном рабочем разряде, что и является причиной потери ёмкости. Поэтому поверхность аккумулятора необходимо поддерживать в чистоте. Хранение свинцово-кислотных аккумуляторов в разряженном состоянии приводит к быстрой потере их работоспособности.
При длительном хранении аккумуляторов и разряде их большими токами (в стартерном режиме), или при уменьшении ёмкости аккумуляторов, нужно проводить контрольно-тренировочные циклы, то есть разряд-заряд токами номинальной величины.
При подготовке аккумуляторной батареи к зимнему хранению, что актуально для автомобилей не эксплуатируемых в холодное время года специалисты старейшей лаборатории НИИАЭ рекомендуют следующие действия:
1. Правильно и до конца зарядите аккумуляторную батарею. 2. Нанесите на положительный вывод АКБ пластичную смазку (допускается только технический вазилин т.к. имеет нетральную кислотность, и не в коем случее не использовать литол, солидол и т. п. т.к. они имеют небольшую кислотность и со временем такие смазки попросту разъедают выводные клеммы АКБ), так как плёнка электролита способна абсорбировать влагу из атмосферы, что может приводить к повышенному саморазряду. 3. Хранить аккумуляторы на холоде, так как при низких температурах саморазряд намного ниже. Электролит полностью заряженного аккумулятора начинает замерзать при температуре ниже −55 С.
В случае необходимости поездки в морозы следует перенести аккумулятор в отапливаемое помещение и в течение 7—9 часов (например, за ночь) он придёт в пригодное для пуска двигателя состояние.
Износ свинцово-кислотных аккумуляторов[править | править код]
При использовании технической серной кислоты и недистиллированной воды ускоряются саморазряд, сульфатация, разрушение пластин и уменьшение ёмкости аккумуляторной батареи[19].
Основными процессами износа свинцово-кислотных аккумуляторов являются:
- сульфатация пластин[3], заключающаяся в образовании крупных кристаллов сульфата свинца, который препятствует протеканию обратимых токообразующих процессов;
- коррозия электродов, то есть электрохимические процессы окисления и растворения материала электродов в электролите, что вызывает осыпание материала электродов;
- слабая механическая прочность или плохое сцепление активной массы с электродными решётками, что приводит к опаданию активной массы[3][20];
- оползание и осыпание активной массы положительных электродов, связанное с разрыхлением, нарушением однородности[3].
Хотя батарею, вышедшую из строя по причине физического разрушения пластин, в домашних условиях восстановить нельзя, в литературе описаны химические растворы и прочие способы, позволяющие «десульфатировать» пластины. Простой, но чреватый полным отказом аккумулятора способ предполагает использование раствора сульфата магния[3]. Раствор сульфата магния заливается в секции, после чего батарею разряжают и заряжают несколько раз. Сульфат свинца и прочие остатки химической реакции осыпаются при этом на дно банок, это может привести к замыканию элемента, поэтому обработанные банки желательно промыть и заполнить новым электролитом номинальной плотности. Это позволяет несколько продлить срок использования устройства.
 Кодовый символ, указывающий на то, что свинцовые батареи могут быть вторично переработаны
Кодовый символ, указывающий на то, что свинцовые батареи могут быть вторично переработаныВторичная переработка для этого вида аккумуляторов играет важную роль, так как свинец, содержащийся в аккумуляторах, является токсичным тяжёлым металлом и наносит серьёзный вред при попадании в окружающую среду. Свинец и его соли должны быть переработаны для возможности его вторичного использования.
Свинец из изношенных аккумуляторов используется для кустарной переплавки, например, при изготовлении грузил рыболовных снастей, охотничьей дроби или гирь. Кустарное извлечение свинца из аккумуляторов серьезно вредит как окружающей среде, так и здоровью плавильщиков, поскольку свинец и его соединения с парами и дымом разносятся по всей округе[21][22].
- ↑ Курзуков Н. И., Ягнятинский В. М. Аккумуляторные батареи. Краткий справочник // М.: ООО «Книжное издательство „За рулём“». — 2008. — 88 с., ил. ISBN 978-5-9698-0236-0. (С. 15).
- ↑ Bertrand Gille Histoire des techniques. — Gallimard, coll. «La Pléiade», 1978, ISBN 978-2070108817.
- ↑ 1 2 3 4 5 6 7 8 Свинцовые аккумуляторы. Эксплуатация: Правда и вымыслы.
- ↑ Н. Ламтев. Самодельные аккумуляторы. Москва: Государственное издательство по вопросам радио, 1936 год.
- ↑ Как отрыть автомобильный аккумулятор: делаем батарею обслуживаемой (рус.), AkkumulyatorAvto.ru (2 августа 2017). Дата обращения 12 августа 2018.
- ↑ Удельная электропроводность х водных растворов серной кислоты и температурный коэффициент аt (неопр.). chemport.ru. Дата обращения 1 июля 2018.
- ↑ Концентрация и плотность серной кислоты. Зависимость плотности серной кислоты от концентрации в аккумуляторе автомобиля (рус.), FB.ru. Дата обращения 1 июля 2018.
- ↑ http://auto.lenta.ru/news/2006/12/19/battery/ Американцы облегчили и уменьшили аккумуляторы
- ↑ Аккумуляторы для бесперебойного питания. Статьи компании «ООО Новая система» (неопр.) (недоступная ссылка). aegmsk.ru. Дата обращения 12 августа 2018. Архивировано 12 августа 2018 года.
- ↑ 1 2 Свинцовый кислотный аккумулятор. Устройство и принцип действия аккумулятора. (рус.). www.eti.su. Дата обращения 1 июля 2018.
- ↑ Расчет идеального свинцового аккумулятора.
- ↑ [1].
- ↑ ГОСТ 26881-86 Методика проверки свинцовых аккумуляторов
- ↑ Краткий аналитический обзор существующих способов оценки ёмкости ХИТ и приборов, реализующих эти способы (неопр.) (недоступная ссылка). Дата обращения 21 октября 2011. Архивировано 4 марта 2016 года.
- ↑ ГОСТ Р 53165-2008: Батареи аккумуляторные свинцовые стартерные для автотракторной техники. Общие технические условия
- ↑ Руководство, 1983, с. 70.
- ↑ Железнодорожный транспорт. — 2011. № 12. — c.35. (неопр.) (недоступная ссылка). Дата обращения 13 декабря 2015. Архивировано 22 декабря 2015 года.
- ↑ Руководство, 1983, с. 21-23.
- ↑ Вредные добавки к электролиту свинцовых аккумуляторов
- ↑ О противоречиях в теории работы свинцового кислотного аккумулятора к. т. н., проф. Кочуров А. А. Рязанский военный автомобильный институт Архивировано 20 сентября 2011 года.
- ↑ Отравление свинцом | ProfMedik Медицинский Портал (рус.) (неопр.) ?. profmedik.ru (22 февраля 2016). Дата обращения 4 февраля 2017.
- ↑ Кочуров. http://echemistry.ru/assets/files/books/hit/statya-o-protivorechiyah-v-teorii-raboty-svincovogo-kislotnogo-akkumulyatora.pdf (рус.). Новости. Первоуральск.Ru (17 июля 2014). Дата обращения 4 февраля 2017.

 Первым делом следует открыть каждую емкость в батарее, плотность электролита в которой должна быть измерена.
Первым делом следует открыть каждую емкость в батарее, плотность электролита в которой должна быть измерена. Канистра с дистиллятом, которая продается в каждом автомагазине, приобрести эту воду можно и в аптеке.
Канистра с дистиллятом, которая продается в каждом автомагазине, приобрести эту воду можно и в аптеке.

