Кислота серная электролит – Электролит Кислотный Для Аккумулятора, Состав и Плотность, Корректирующий Раствор Для Свинцового АКБ, Зарядка Батареи, Изготовление Своими Руками
- 18.02.2020
Серная кислота как электролит
Цель: изучение свойств разбавленной серной кислоты.
Задачи:
- сформировать знания о свойствах серной кислоты как электролита;
- формировать коммуникативные, познавательные и исследовательские умения;
- развивать умение составлять уравнения химических реакций в молекулярном и ионном видах; воспитывать аккуратность в обращении и химическими веществами.
Формы организации познавательной деятельности учащихся: фронтальная, групповая, индивидуальная.
Оборудование: пробирки, спиртовка, спички, держатель для пробирки, химический стакан, лучина, инструктивные карточки, таблица растворимости.
Реактивы: цинк, железо, медь; оксид меди, оксид кремния; раствор гидроксида натрия, фенолфталеин; растворы карбоната калия, хлорида натрия и хлорида бария; раствор серной кислоты, концентрированная серная кислота, сахарная пудра.
Ход урока
I. Организация
– Я всех приветствую на нашем уроке и желаю плодотворной работы!
II. Изучение новых знаний
– При Петре I это вещество привозили в Россию из-за границы. Но уже в 1798 г. купец Муромцев «выварил» 125 пудов (около двух тонн) этого вещества нагреванием железного купороса. «Купоросная кислота», «купоросное масло», «серное масло», «купоросный спирт» так называли в XVII-XVIII веках это вещество. Как вы думаете, какое современное название этого вещества?
Предполагаемый ответ учеников:
– Современное название этого вещества — серная кислота.
– Серную кислоту называют хлебом химической промышленности, так как нет ни одной отрасли, где бы она не использовалась. Чтобы правильно применять вещество, надо знать его свойства. Что же будет являться целью нашего урока?
(Формулировка цели урока вместе с учениками).
– Вашим путеводителем на уроке будет учебник химии, а помощником – химический эксперимент.
Из курса химии 8 класса вы знаете, что каждому кислотному оксиду соответствует своя кислота. Вспомните, какой оксид соответствует серной кислоте.
Предполагаемый ответ учеников:
– Серной кислоте соответствует оксид серы (VI).
– Используя учебник (с.136), выполните задания инструктивной карточки №1.
Индивидуальная работа учеников по инструктивной карточке №1:
Инструктивная карточка №1 «Оксид серы (VI)»
Используя текст учебника на с.136, заполните схему:
Оксид серы (VI) или серный ангидрид
Формула…
Молярная масса…
Физические свойства…
Получение…
Характер оксида…
Уравнение реакции с водой…
Проверка выполнения задания (беседа по вопросам):
– Какую формулу имеет оксид серы (VI)? (записать на доске)
– Какими физическими свойствами он обладает?
– Каков характер данного оксида?
– Что получается при взаимодействии серного ангидрида с водой? Запишите уравнение реакции.
– Видим, что при растворении оксида серы (VI) в воде получается серная кислота. Что из себя представляет химически чистая серная кислота? Чтобы ответить на этот вопрос, выполните задания инструктивной карточки №2.
Индивидуальная работа учеников по инструктивной карточке №2:
Инструктивная карточка №2 «Серная кислота»
Используя текст учебника на с. 136 заполните схему:
Серная кислота
Формула…
Молярная масса…
Физические свойства…
Правило растворения…
Отношение концентрированной серной кислоты к органическим веществам…
Проверка выполнения задания (беседа по вопросам):
– Что из себя представляет химически чистая серная кислота?
– Как следует разбавлять концентрированную серную кислоту?
– Как концентрированная серная кислота воздействует на органические вещества?
Демонстрация опытов:
- Растворение концентрированной серной кислоты. (попутно можно повторить, что растворение сопровождается выделением тепла. Какой это процесс?)
- Обугливание лучины и сахарной пудры.
– При добавлении воды к концентрированной серной кислоты получается раствор серной кислоты. Какими свойствами она будет обладать? Будет ли она проявлять типичные свойства кислот или ей будут присущи особенные свойства? Исследуйте, какие свойства будет проявлять разбавленная серная кислота?
Работа проводится в группах (4 группы) по инструктивным карточкам.
Задание для первой группы:
Инструктивная карточка №3 «Изучение свойств раствора серной кислоты»
- Изучите отношение различны металлов к раствору серной кислоты. Zn, Fe, Cu.
- Обсудите сообща результат.
- Напишите химические уравнения.
Вопрос. С какими металлами и с каким результатом реагирует разбавленная серная кислота?
Задание для второй группы:
Инструктивная карточка №4 «Изучение свойств раствора серной кислоты»
- Изучите отношение оксидов к раствору серной кислоты: CuOи SiO2 (при нагревании).
- Обсудите результаты опытов.
- Запишите уравнение реакции.
Вопрос. С какими оксидами взаимодействует разбавленная серная кислота?
Задание для третьей группы:
Инструктивная карточка №5 «Изучение свойств раствора серной кислоты»
- Изучите отношение гидроксидов к раствору серной кислоты: NaOH (в присутствии фенолфталеина).
- Обсудите результаты опытов.
- Запишите уравнение реакции.
Вопрос. С каким классом веществ взаимодействует раствор серной кислоты?Как называется такой тип реакции?
Задание для четвертой группы:
Инструктивная карточка №6 «Изучение свойств раствора серной кислоты»
- Изучите отношение солей к раствору серной кислоты: K2СO3, NaCl и BaCl2.
- Обсудите результаты опытов.
- Запишите уравнение реакции.
Вопрос. Взаимодействует ли раствор серной кислоты с солями? В каком случае реакция практически не идет? Почему?
Вопросы для обсуждения:
- С какими металлами и с каким результатом реагирует разбавленная серная кислота?
- С какими оксидами взаимодействует разбавленная серная кислота?
- Взаимодействут ли серная кислота с основаниями? Как называется реакция между сильной кислотой и сильным основанием? Запишите краткое ионное уравнение, отражающее суть реакции между растворами серной кислоты и гидроксидом бария?
- Взаимодействует ли раствор серной кислоты с солями? В каком случае реакция практически не идет? Почему?(Вспомнить правила протекания химических реакций между растворами электролитов до конца.)
– Какой вывод можно сделать на основании проведенных исследований?
Предполагаемый ответ учеников:
– Разбавленная серная кислота проявляет типичные свойства кислот: она взаимодействует с металлами, стоящими в электрохимическом ряду до водорода, взаимодействует с основными оксидами, основаниями, и солями.
(Ученики записывают на доске соответствующие уравнения реакций)
Zn + H2SO4 = ZnSO4 + H2↑
CuO +H2SO4 = CuSO4+ H2O
2 NaOH+ H2SO4 = Na2SO4 + 2H2O
2OH—+ 2H+ = 2 H2O
K2CO3 +H2SO4 = K2SO4 + CO2↑ + H2O NaCl+ H2SO4 – реакция не идет
BaCl2 +H2SO4 = BaSO4 ↓ + 2HCl
Ba2+ + SO42-= BaSO4 ↓ – качественная реакция на серную кислоту и её соли.
– Реактивом на серную кислоту и её соли является хлорид бария BaCl2. Сульфат – ионы SO42 с ионами бария Ba2+ белый нерастворимый сульфат бария, который выпадает в осадок.
– Серная кислота двухосновная. Какие соли будет образовывать серная кислота? Для ответа на вопрос воспользуйтесь текстом учебника на с.137.
Предполагаемый ответ учеников:
Серная кислота будет образовывать два ряда солей: средние – сульфаты и кислые гидросульфаты.
(Вместе с учениками составить схему)
III. Закрепление
Что нового вы узнали о серной кислоте?
Какой вывод можно сделать о свойствах раствора серной кислоты?
IV. Домашнее задание
§23, с.136 – 137, №3.
Серная кислота электролитах — Справочник химика 21
Состав электролита. Католит — 40 мл дистиллированной воды, подкисленной 1,5 мл 0,1 н. раствором серной кислоты. Электролит средней камеры 240 мл насыщенного раствора йодистого тетрабутиламмония. Анолит — 60 мл 2%-ного раствора серной кислоты .Подготовка электролита. Вследствие расхождения Вт(а) и Вт(к) электролит обогащается медью. Переход с анода в раствор избыточного количества меди, а также ионов металлов, не осаждающихся на катоде (никеля, цинка и железа), способствует уменьшению концентрации серной кислоты в растворе. Поэтому состав электролита следует корректировать по содержанию меди, серной кислоты и накапливающихся примесей. Регенерация электролита до постоянного заданного состава проводится в отделении регенерации. Избыток меди удаляется электроэкстракцией в ваннах регенерации с нерастворимыми анодами либо в виде кристаллов медного купороса. Оба продукта в дальнейшем используются. [c.309]
Получение водорода (потребляемого в больших количествах при синтезе аммиака) осуществляется во многих случаях путем электролитического разложения воды. Ввиду очень малой электропроводности воды, для уменьшения расхода электроэнергии электролизу подвергают не чистую воду, а раствор такого электролита, ионы которого, отличные от и ОН», разряжаются много труднее, чем ионы Н+ и 0Н . В результате этот электролит практически полностью сохраняется, а вода разлагается на водород и кислород. К таким электролитам принадлежат, в частности, едкий натр, серная кислота. [c.447]
Свинцовый аккумулятор состоит из двух свинцовых пластин в виде решеток или рам с ребристой поверхностью. Отверстия в пластинах замазаны тестом из окиси свинца РЬО и воды и опущены в 20%-пый раствор серной кислоты (электролит). При взаимодействии окиси свинца с серной кислотой поверхностно образуется сульфат свинца [c.363]
Когда плотность раствора перестанет повышаться и начнется равномерное газовыделение, заряд прекращают. Аккумуляторы в течение 2 час разряжают током, составляющим 20% от Ю-час разрядного тока, затем заряжают в том же режиме до получения постоянства напряжения и плотности электролита. Повторно разряжают и заряжают, пока не достигнут постоянства напряжения и плотности электролита. После этого добавлением раствора свежей серной кислоты электролит доводят до плотности 1,20—1,21. Для перемешивания электролита аккумуляторы дополнительно заряжают нормальным зарядным током до наступления сильного и равномерного газовыделения. [c.261]
Впервые исследовано анодное окисление высокоориентированного пиролитического графита в электролите, содержащем безводные фосфорную и серную кислоты. Синтез проводился в гальваностатическом режиме с использованием тока / = 0,5 мА при повышенной температуре (t = 80 С). [c.129]
Возникновение электрического тока в гальваническом элементе объясняется следующим. В растворе серной кислоты (электролите) молекулы вещества распадаются на части, которые называются ионами. Ионы каждого химического вещества несут определенный химический заряд положительный (катион) или отрицательный (анион). [c.50]
В отличие от медно-цинкового элемента, во всех современных гальванических элементах и аккумуляторах используют не два, а один электролит такие источники тока значительно удобнее в эксплуатации. Например, в свинцовых аккумуляторах (см. 189) электролитом служит раствор серной кислоты. [c.278]
При высоком содержании серной кислоты в электролите избыток ее необходимо удалить. Осаждение серной кислоты производят введением В разогретый до 50—60°С электролит углекислого бария из расчета 2 г на 1 г удаляемой серной кислоты. Электролит перемешивают, а затем отстаивают в течение суток. [c.67]
Недостатки способа хромирования низкая скорость осаждения (24—50 мкм/ч) и плохая смачиваемость хрома маслами. Поэтому хромирование используется только при небольшой степени износа. В ремонтном производстве наибольшее применение находит электролит, содержаш,ий 150 г/л хромового ангидрида, 1,5 г/л серной кислоты, а также электролит, состояш,ий из 250 г/л хромового ангидрида и 2,5 г/л серной кислоты. [c.94]
На отрицательном электроде по мере перетока электронов В10 внешнюю цепь происходит окисление свинца до двухвалентных ионов РЬ +. Эти ионы свинца будут переходить в раствор серной кислоты — электролит и взаимодействовать с сульфат-ионами 804 , образуя также сульфат свинца, который будет осаждаться на поверхности отрицательного электрода. Процесс разряда свинцового аккумулятора записывается следующим ур авнением [c.20]
Приготовление электролита. Необходимое количество хромового ангидрида растворяют в минимальном количестве воды и декантируют в рабочую ванну. Затем туда же вливают ортофосфорную кислоту. В охлажденный раствор осторожно, непрерывно помешивая, добавляют серную кислоту. Электролит нагревают при температуре 100—110° и выдерживают при этой температуре до тех пор, пока удельный ес его не достигнет требуемой величины. Охлажденный свежеприготовленный электролит прорабатывают в течение 1—2 ч с алюминиевыми электродами. Если плотность превышает величину, указанную в табл. 30, то электролит разбавляют водой. [c.76]
Однако необходимо отметить, что в случае добавки кремнефтористоводородной и серной кислот (электролит VI) распределение металла лучше, чем в случае добавки сернокислого стронция (электролит //). [c.210]
Б. Н. Кабанов предложил эффективный метод исправления засульфатироваиных пластин, заключающийся в удалении адсорбированных веществ с их поверхности при зарядной плотности тока 0,1 А/см или в 10 раз превышающей обычную. Технически более доступным является другой метод электролит заменяют дистиллированной водой, в которой растворимость сульфата свянца значительно выше, я проводят заряд током 0,025- -0,01 Сном. После достижения постоянства концентрации серной кислоты электролит вновь заменяют водой н операцию повторяют. [c.186]
В безводной муравьиной кислоте [4] бензолсульфокислота диссоциирована ПОЧТИ одинаково с серной кислотой, являющейся в этом растворителе одноосновной кислотой. В растворах метилового и этилового спиртов бензолсульфокислота также ведет себя, как сильный электролит [5]. [c.198]
Катодный осадок меди (из ванны регенерации) с повышенным содержани
Как из электролита получить серную кислоту
В настоящее время выбор аккумуляторных батарей огромен — в продаже можно найти уже готовые к использованию источники питания, а также сухозаряженные батареи, которые требуют осуществить приготовление электролита и его заливку до начала эксплуатации. Дальнейшее обслуживание аккумуляторов многие часто осуществляют в сервисах. По разным причинам может возникнуть необходимость самостоятельно приготовить раствор. Чтобы это мероприятие увенчалось успехом, следует знать, как сделать электролит в домашних условиях.
Что такое электролит?

Электролит — электропроводящий раствор, содержащий в своём составе дистиллированную воду и серную кислоту, едкий калий или натрий в зависимости от типа источника питания.
Концентрация серной кислоты в АКБ
Этот показатель кислотности напрямую зависит от необходимой плотности электролита. Изначально средняя концентрация этого раствора в автомобильном аккумуляторе — около 40% в зависимости от температуры и климата, в которых используется источник питания. Во время эксплуатации концентрация кислоты падает до 10–20%, что сказывается на работоспособности АКБ.
Вместе с тем стоит понимать, что аккумуляторная серная составляющая — наичистейшая жидкость, которая на 93% состоит непосредственно из кислоты остальные 7% — примеси. На территории России производство этого химиката строго регламентировано — продукция должна соответствовать требованиям ГОСТ.
Отличия электролитов для разных типов аккумуляторов
Несмотря на то что принцип работы раствора одинаков для разных источников питания, следует знать о некоторых различиях составов. В зависимости от состава принято выделять щелочной и кислотный электролиты.
Щелочные АКБ

Этот вид источников питания характеризуется наличием гидроокиси никеля, окиси бария и графита. Электролит в этом виде аккумуляторов представляет собой 20% раствор едкого калия. Традиционно используется добавка моногидрата лития, которая позволяет продлить срок эксплуатации АКБ.
Щелочные источники питания отличаются отсутствием взаимодействия калийного раствора с веществами, образуемыми во время работы аккумулятора, что способствует аксимальному уменьшению расхода.
Кислотные АКБ

Этот вид источников питания является одним из самых традиционных, поэтому и раствор в них знаком многим — смесь дистиллированной воды и серного раствора. Концентрат электролита для свинцово-кислотных аккумуляторов дешёво стоит и характеризуется способностью проводить ток большой величины. Плотность жидкости должна соответствовать климатическим показателям.
Таблица 1. Рекомендуемая плотность электролита
Другие виды АКБ: можно ли приготовить электролит для них самостоятельно?

Отдельно хотелось бы обратить внимание на современные свинцово-кислотные источники питания — гелевые и AGM. Они также могут быть заправлены собственноручно приготовленным раствором, который в них находится в специфической форме — в виде геля или внутри сепараторов. Для заправки гелевых аккумуляторов понадобится ещё один химический компонент — силикагель, который загустит кислотный раствор.
Кадмиевоникелевые и железоникелевые аккумуляторы
В отличие от свинцовых источников питания, кадмиево- и железоникелевые заливаются щелочным растовром, который является смесью дистиллированной воды и едкого калия или натрия. Гидроксид лития, входящий в состав этого раствора для определённых температурных режимов, позволяет увеличить срок службы АКБ.

Таблица 2. Состав и плотность электролита для кадмиево- и железоникелевых и аккумуляторов.
Железоникелевые источники питания рекомендуется эксплуатировать в тех же условиях, что и кадмиево-никелевые. Однако стоит отметить, что они более восприимчивы к низким температурам. Поэтому их следует использовать до минус 20 градусов.
Как правильно приготовить электролит в домашних условиях: техника безопасности
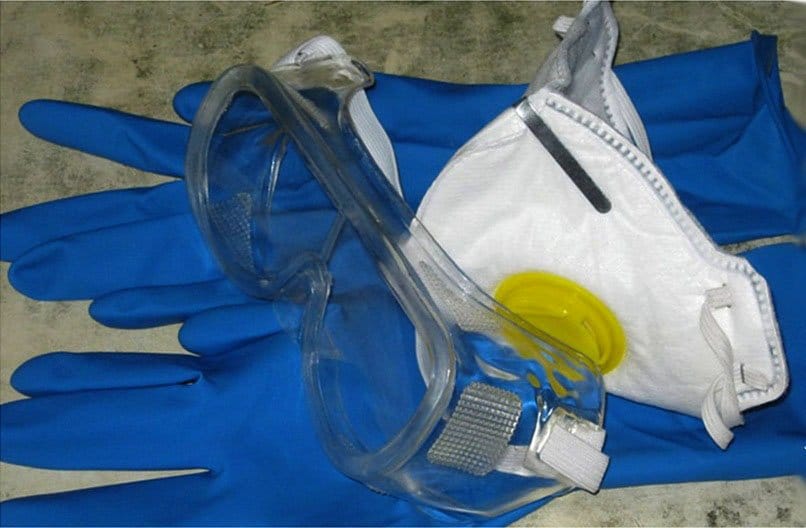
Приготовление раствора — работа с кислотами и щелочами, поэтому соблюдение мер предосторожности необходимо для самых опытных людей. Перед началом действия подготовьте средства защиты:
- резиновые перчатки
- одежду и фартук, устойчивый химическим веществам;
- защитные очки;
- нашатырный спирт, кальцинированную соду или борный раствор, чтобы нейтрализовать кислоту и щёлочь.
Оборудование
Для приготовления аккумуляторного электролита помимо самого источника питания потребуются следующие предметы:
- ёмкость и палочка, устойчивые к воздействию кислот и щелочей;
- дистиллированная вода;
- инструменты для измерения уровня, плотности и температуры раствора;
- аккумуляторная серная жидкость — для кислотной АКБ, твёрдые или жидкие щелочи, литий — для соответствующих видов АКБ, силикагель — для гелевых аккумуляторов.
Последовательность процесса: делаем электролит для кислотно-свинцового источника питания
Перед началом работ ознакомьтесь с информацией, приведённой в таблице 3. Она позволит выбрать необходимый объем жидкостей. В аккумуляторах залито от 2,6 до 3,7 литра кислотного раствора. Мы рекомендуем разводить примерно 4л электролита.
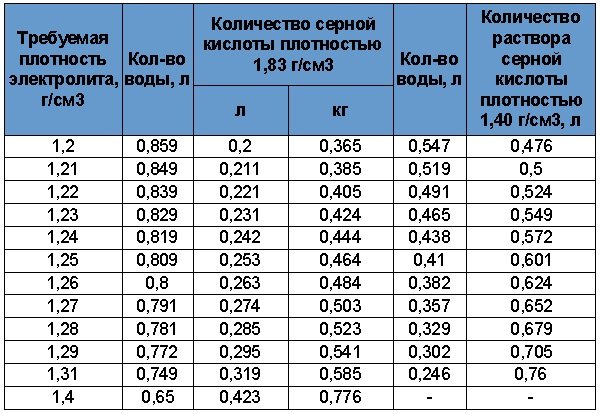
Таблица 3. Пропорции воды и серной кислоты.
- В ёмкость, устойчивую к едким веществам, налейте нужный объем воды.
- Разбавлять воду кислотой следует постепенно.
- По окончании процесса вливания замеряйте плотность получившегося электролита с помощью ареометра.
- Дайте составу отстояться около 12 часов.
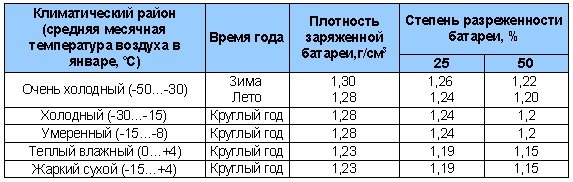
Таблица 4. Плотность электролита для разных климатов.
Концентрация кислотного раствора должна соотноситься с минимальной температурой, при которой эксплуатируется аккумулятор. Если жидкость получилась слишком концентрированной, её необходимо разбавить дистиллированной водой.
Смотрите видео, как измерить плотность электролита.
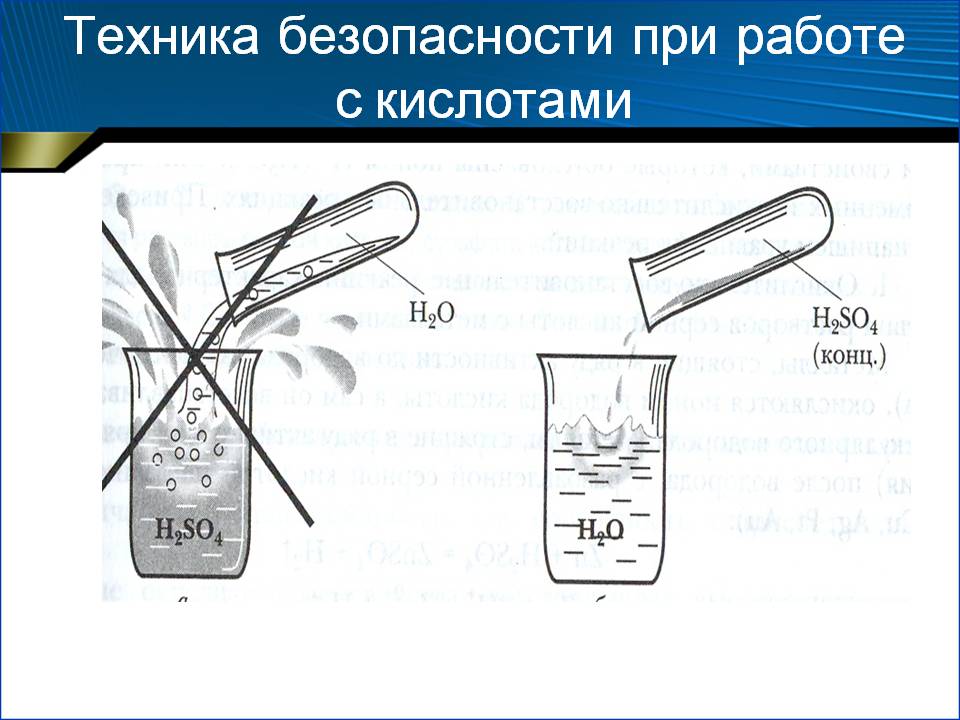
Обращаем ваше внимание, что во время смешивания компонентов выделяется тепло. В подготовленный аккумулятор следует заливать остывший раствор.
Способ развести электролит для щелочного источника питания
Плотность и количество электролита в таких аккумуляторах указана в инструкции по эксплуатации источника питания или на сайте компании-производителя.
Необходимая плотность раствора
Количество твёрдой щелочи равняется количеству электролита, разделенному на
Разделы: Химия
Цель: изучение свойств разбавленной серной кислоты.
Задачи:
- сформировать знания о свойствах серной кислоты как электролита;
- формировать коммуникативные, познавательные и исследовательские умения;
- развивать умение составлять уравнения химических реакций в молекулярном и ионном видах; воспитывать аккуратность в обращении и химическими веществами.
Формы организации познавательной деятельности учащихся: фронтальная, групповая, индивидуальная.
Оборудование: пробирки, спиртовка, спички, держатель для пробирки, химический стакан, лучина, инструктивные карточки, таблица растворимости.
Реактивы: цинк, железо, медь; оксид меди, оксид кремния; раствор гидроксида натрия, фенолфталеин; растворы карбоната калия, хлорида натрия и хлорида бария; раствор серной кислоты, концентрированная серная кислота, сахарная пудра.
Ход урока
I. Организация
– Я всех приветствую на нашем уроке и желаю плодотворной работы!
II. Изучение новых знаний
– При Петре I это вещество привозили в Россию из-за границы. Но уже в 1798 г. купец Муромцев «выварил» 125 пудов (около двух тонн) этого вещества нагреванием железного купороса. «Купоросная кислота», «купоросное масло», «серное масло», «купоросный спирт» так называли в XVII-XVIII веках это вещество. Как вы думаете, какое современное название этого вещества?
Предполагаемый ответ учеников:
– Современное название этого вещества — серная кислота.
– Серную кислоту называют хлебом химической промышленности, так как нет ни одной отрасли, где бы она не использовалась. Чтобы правильно применять вещество, надо знать его свойства. Что же будет являться целью нашего урока?
(Формулировка цели урока вместе с учениками).
– Вашим путеводителем на уроке будет учебник химии, а помощником – химический эксперимент.
Из курса химии 8 класса вы знаете, что каждому кислотному оксиду соответствует своя кислота. Вспомните, какой оксид соответствует серной кислоте.
Предполагаемый ответ учеников:
– Серной кислоте соответствует оксид серы (VI).
– Используя учебник (с.136), выполните задания инструктивной карточки №1.
Индивидуальная работа учеников по инструктивной карточке №1:
Инструктивная карточка №1 «Оксид серы (VI)»
Используя текст учебника на с.136, заполните схему:
Оксид серы (VI) или серный ангидрид
Уравнение реакции с водой…
Проверка выполнения задания (беседа по вопросам):
– Какую формулу имеет оксид серы (VI)? (записать на доске)
– Какими физическими свойствами он обладает?
– Можно ли оксид серы (VI) получить из серы путем её сжигания?
– Каков характер данного оксида?
– Что получается при взаимодействии серного ангидрида с водой? Запишите уравнение реакции.
– Видим, что при растворении оксида серы (VI) в воде получается серная кислота. Что из себя представляет химически чистая серная кислота? Чтобы ответить на этот вопрос, выполните задания инструктивной карточки №2.
Индивидуальная работа учеников по инструктивной карточке №2:
Инструктивная карточка №2 «Серная кислота»
Используя текст учебника на с. 136 заполните схему:
Отношение концентрированной серной кислоты к органическим веществам…
Проверка выполнения задания (беседа по вопросам):
– Что из себя представляет химически чистая серная кислота?
– Как следует разбавлять концентрированную серную кислоту?
– Как концентрированная серная кислота воздействует на органические вещества?
- Растворение концентрированной серной кислоты. (попутно можно повторить, что растворение сопровождается выделением тепла. Какой это процесс?)
- Обугливание лучины и сахарной пудры.
– При добавлении воды к концентрированной серной кислоты получается раствор серной кислоты. Какими свойствами она будет обладать? Будет ли она проявлять типичные свойства кислот или ей будут присущи особенные свойства? Исследуйте, какие свойства будет проявлять разбавленная серная кислота?
Работа проводится в группах (4 группы) по инструктивным карточкам.
Задание для первой группы:
Инструктивная карточка №3 «Изучение свойств раствора серной кислоты»
- Изучите отношение различны металлов к раствору серной кислоты. Zn, Fe, Cu.
- Обсудите сообща результат.
- Напишите химические уравнения.
Вопрос. С какими металлами и с каким результатом реагирует разбавленная серная кислота?
Задание для второй группы:
Инструктивная карточка №4 «Изучение свойств раствора серной кислоты»
- Изучите отношение оксидов к раствору серной кислоты: CuOи SiO2 (при нагревании).
- Обсудите результаты опытов.
- Запишите уравнение реакции.
Вопрос. С какими оксидами взаимодействует разбавленная серная кислота?
Задание для третьей группы:
Инструктивная карточка №5 «Изучение свойств раствора серной кислоты»
- Изучите отношение гидроксидов к раствору серной кислоты: NaOH (в присутствии фенолфталеина).
- Обсудите результаты опытов.
- Запишите уравнение реакции.
Вопрос. С каким классом веществ взаимодействует раствор серной кислоты?Как называется такой тип реакции?
Задание для четвертой группы:
Инструктивная карточка №6 «Изучение свойств раствора серной кислоты»
- Изучите отношение солей к раствору серной кислоты: K2СO3, NaCl и BaCl2.
- Обсудите результаты опытов.
- Запишите уравнение реакции.
Вопрос. Взаимодействует ли раствор серной кислоты с солями? В каком случае реакция практически не идет? Почему?
Вопросы для обсуждения:
- С какими металлами и с каким результатом реагирует разбавленная серная кислота?
- С какими оксидами взаимодействует разбавленная серная кислота?
- Взаимодействут ли серная кислота с основаниями? Как называется реакция между сильной кислотой и сильным основанием? Запишите краткое ионное уравнение, отражающее суть реакции между растворами серной кислоты и гидроксидом бария?
- Взаимодействует ли раствор серной кислоты с солями? В каком случае реакция практически не идет? Почему?(Вспомнить правила протекания химических реакций между растворами электролитов до конца.)
– Какой вывод можно сделать на основании проведенных исследований?
Предполагаемый ответ учеников:
– Разбавленная серная кислота проявляет типичные свойства кислот: она взаимодействует с металлами, стоящими в электрохимическом ряду до водорода, взаимодействует с основными оксидами, основаниями, и солями.
(Ученики записывают на доске соответствующие уравнения реакций)
2OH — + 2H + = 2 H2O
NaCl+ H2SO4 – реакция не идет
Ba2+ + SO4 2- = BaSO4 ↓ – качественная реакция на серную кислоту и её соли.
– Реактивом на серную кислоту и её соли является хлорид бария BaCl2. Сульфат – ионы SO4 2 с ионами бария Ba 2+ белый нерастворимый сульфат бария, который выпадает в осадок.
– Серная кислота двухосновная. Какие соли будет образовывать серная кислота? Для ответа на вопрос воспользуйтесь текстом учебника на с.137.
Предполагаемый ответ учеников:
Серная кислота будет образовывать два ряда солей: средние – сульфаты и кислые гидросульфаты.
(Вместе с учениками составить схему)
III. Закрепление
Что нового вы узнали о серной кислоте?
Какой вывод можно сделать о свойствах раствора серной кислоты?
![]()
Дубликаты не найдены
Говорят что если засунуть руку в банку с кислотой, то можно ощутить что у банки нет дна !
клево! но мне даже облить ей не кого =(
из серной делаешь азотную. потом смешиваешь две кислоты. запихиваешь туда вату. промываешь вату водойю сушишь. получаешь нитроцилюлозу. есть еще вариант. берешь ацетон перекись водорода и кислоту. смешиваешь. фильтруешь. бьеш по осадку молотком. участвуешь в похоронах. в своих естесно
на ютубе удалено, что там было?
Мне кажется без знания реакции НЕЛЬЗЯ ничего делать.
как делаешь азотную? какие две кислоты смешиваешь? подробности, сэр!
Просто дождись, рано или поздно какая-то красотка разобьет тебе сердце.
у меня есть жена. хм, @OgnennoeTV а в акриловой ванне можно кислоту хранить, и как много надо чтобы труп расплавить и можно ли это слить в канализацию будет?
Надо быть смелым чтобы шутить так в интернете в наши то дни в нашей стране.
Да нормально он женат. цать% разводов заканчиваются в ванной с кислотой или в лесу на даче.
тут бы зашел комментарий «Да нормально, он же в церкви плясать/покемонов ловить собрался»
тут бы зашел комментарий «Да нормально, он же не пишет в вк, что бога нет»

Занятная математика. Считать человека проще в литрах, одним куском неудобно. Рекомендуют обычно щелочь. Сколько литров человека во скольки литрах крота растворится — нужно проверять. И смывать удобно, как бы сам себя раствор промывает.
Расплавить — неграмотно технически. В «разрушителях мифов» была использована добавка — надо примерно треть соляной кислоты добавлять. Не благодарите. Дайте только остатки пожевать.
Самый простой способ)

Вот мне кажется это лишние.
всё видео сводится к:
1. Берём электролит
2. Наливаем в стекло
3. Ставим на огонь
4. Ждём белого густого дыма
5. У Вас >90% серка
Ну там еще есть момент, где человек говорит, что всё это не руководство к действию, а просто для расширения ваших знаний в области химии. При этом смеется как дегенерат. По-моему это самая полезная информация в видео. Будь он моим знакомым, я бы сделал выводы и держался от него подальше.
просто мои ролики часто роскомнадзор банит, как опасные для лиц младшего возраста))
по этому пришлось сказать эту фразу и аж самому смешно стало)))))
Забавный Вы человек.
У Вас есть видео, где Вы 12 минут ноете о том, что Википедия слишком много рассказывает о том, как можно сделать взрывчатку. С акцентом на то, какие они плохие и общественно опасные.
А когда вы объясняете как сделать опасное вещество (кислоту), которая так же в руках «Дурака» может стать общественно опасной. Вам смешно.
Мне кажется, что Вы лицемерите.
Нельзя одновременно осуждать Википедию за то, что там написано как получали первый порох и тут же рассказывать как получить серную кислоту. При этом одно считать плохим, а другое нормой.
Серная кислота аккумуляторная — Справочник химика 21
Для приготовления электролита можно пользоваться только специальными сортами серной кислоты (серная кислота аккумуляторная). В ней не допускается присутствие мышьяка и железа в заметных количествах (эти примеси вредны для аккумулятора). [c.354]Серная кислота аккумуляторная (фасовка 1,5 кг). …… 228,0 2000 2400 2400 54 7,2 [c.259]
Компоненты Серная кислота (по ГОСТ 2184-77) Серная кислота аккумуляторная (по ГОСТ 667-73) Серная кислота реактивная (по ГОСТ 4204-77) [c.279]
Серная кислота аккумуляторная. …….. 300 450 [c.26]
ГОСТ 2184—59, Кислота серная ГОСТ 667—53, Серная кислота аккумуляторная. [c.44]
Для розничной продажи выпускают серную кислоту аккумуляторную крепкую в склянках по 0,8 и 1,7 кг (ТУ МХП ОШ-208—52) и серную кислоту техническую—купоросное масло в склянках по 0,8 и 1,7 кг ТУ МХП ОШ-209—50). [c.93]
Для окончательной очистки метатитановой кислоты от примесей, в основном от железа, после промывки ее подвергают обработке кислотой в присутствии восстановителей. Эту операцию, известную под названием отбелки, производят таким образом, что промытую пасту метатитановой кислоты загружают в бак, добавляют чистую серную кислоту (аккумуляторную) и воду из расчета концентрации кислоты 5—10% и ТЮг (в суспензии) 300 г/л, после чего добавляют цинковую пыль в количестве 0,5% от веса ТЮг. Пульпу нагревают до 80—90° острым паром до перехода части титана (— 0,5 г/л) в раствор в виде Т1г(504)з. При этом примеси железа, хрома, ванадия, поглощенные осадком, восстанавливаются и извлекаются кислотой. После отбелки метатитановую кислоту промывают на вакуум-фильтре и направляют на прокаливание. [c.173]
Серная кислота техническая Серная кислота аккумуляторная, Серная кислота реактивная [c.28]
Сорта серной кислоты. В соответствии с требованиями государственных общесоюзных стандартов выпускается несколько сортов серной кислоты. Различают техническую серную кислоту, аккумуляторную и реактивную. [c.375]
Получение аккумуляторной серной кислоты. Аккумуляторная кислота выпускается сортов А и Б, отличающихся между собой содержанием примесей. [c.179]
Здесь приведем лишь средства для автомобильных аккумуляторов. Для приготовления электролита к аккумуляторным батареям используют серную кислоту аккумуляторную (92—94 %). Электролит готовят только в керамической или стеклянной посуде. Пользоваться любой металлической посудой категорически запреш,ается, поскольку серная кислота с металлами вступает в реакцию. При смешивании всегда кислоту лить тонкой струей в воду, а не наоборот, так как в противном случае происходит интенсивное разбрызгивание кислоты, что может привести к ожогам. [c.298]
В процессе СО-2 получают 70—90% технической серной кислоты и 30—10% чистой серной кислоты (аккумуляторной, реактивной или улучшенной для текстильной промышленности) часть продукции может быть выдана в виде олеума. При двойном контактировании общая степень окисления сернистого ангидрида на катализаторе составляет 99,4%, что исключает необходимость дополнительной санитарной очистки отходящих газов. [c.296]
Серная кислота аккумуляторная (ГОСТ 667—73) и техническая конта улучшенная (ГОСТ 2184—67) содержит 92—94% моногидрата (h3SO4), не 0,0001% мышьяка и столько же окислов азота (N2O3), Кислота поступг спиртовые заводы в стальных железнодорожных цистернах грузоподъем до 50 т и хранится также в стальных резервуарах. Учитывают и дозируют содержанию моногидрата. [c.32]
Серная кислота аккумуляторная (ГОСТ 667—73), нлн контактная техническая (ГОСТ 2184—77),—бесцветная, светло-нлн темно-желтого цвета маслянистая жидкость. Может применяться и кислота, содержащая в небольшом количестве взвешенные ве-ш,ества. Содержание моногидрата серной кислоты составляет 92— 94% мае., мышьяка — не более 0,0001 и оксидов азота (ЫаОз) — не более 0,0001% мае. Серная кислота используется для поддержания pH среды в оптимальных пределах в процессе дрожжегеиерацни. Расход ее учитывают по моногидрату. Транспортируется и хранится в специальных цистернах и емкостях нз спецстали. [c.240]
Использование обычных цистерн (общего парка) для перевозки кислот запрещается. Все кислотные цистерны парка МПС приписаны к станциям налива. Серную кислоту, аккумуляторную, башенную, или гловерную, моногидрат, купоросное масло перевозят только в специальных сернокислых цистернах олеум (серная дымящаяся кислота) —в специальных олеумных утепленных цистернах-термосах, принадлежащих грузоотправителю. Меланж (смесь азотной кисоты с серной) перевозят в специальных меланжевых цистернах, приписанных к станциям налива, и с разрешения Министерства путей сообщения — в сернокислых цистернах. Соляную кислоту перевозят только в специально приспособленных, гуммированных внутри цистернах, принадлежащих грузоотправителю. Ингибированную соляную и хлорсуль-фоновую кислоты перевозят в специально выделенных сернокислотных цистернах МПС. При выделении таких цистерн грузоотправитель в три слоя красит внутренние поверхности химически стойкой эмалью и покрывает ее двумя слоями химически стойкого лака. Азотную, уксусную и фосфорную кислоты перевозят только в специальных цистернах грузоотправителя или грузополучателя. [c.135]
Законы роста пленки хорошо иллюстрируются кривыми падения тока на свинцо,во.м аноде в серной кислоте ( аккумуляторной концентрации ) Мюллера и Маха, воспроизведенны.ми на фиг. 11. Кривая, обозначенная /, изображает ток в различное время нужно отметить, что период быстрого падения длится только долю секунды, и необходим, конечно, специальный осциллограф, чтобы отметить подо1бные величины. Небольшая продолжительность пассивации обязана низкой растворимости сернокислого свинца подобные кривые для железного анода дают продолжительность пассивации в течение [c.65]
Серная кислота (Н2504). В производстве кормовых дрожжей применяется серная кислота аккумуляторная ГОСТ 667-73 или техническая ГОСТ 2184-77, бесцвет- [c.90]
Концентрация и плотность серной кислоты. Зависимость плотности серной кислоты от концентрации в аккумуляторе автомобиля
Разбавленная и концентрированная серная кислота — это настолько важные химические продукты, что в мире их вырабатывается больше, чем любых других веществ. Экономическое богатство страны может быть оценено по объему производимой в ней серной кислоты.
Процесс диссоциации
Серная кислота находит применение в виде водных растворов различной концентрации. Она подвергается реакции диссоциации в два этапа, производя H+-ионы в растворе.
H2SO4 = H+ + HSO4— ;
HSO4— = H + + SO4-2 .
Серная кислота является сильной, и первый этап ее диссоциации происходит настолько интенсивно, что практически все исходные молекулы распадаются на H+-ионы и HSO4 -1 -ионы (гидросульфата) в растворе. Последние частично распадаются дальше, выделяя другой H+-ион и оставляя сульфат-ион (SO4-2 ) в растворе. Однако гидросульфат, будучи слабой кислотой, все же превалирует в растворе над H+ и SO4-2 . Полная диссоциация его происходит только, когда плотность раствора серной кислоты приближается к плотности воды, т. е при сильном разбавлении.
Свойства серной кислоты
Она является особенной в том смысле, что может действовать как обычная кислота или как сильный окислитель — в зависимости от ее температуры и концентрации. Холодный разбавленный раствор серной кислоты реагирует с активными металлами с получением соли (сульфата) и выделением газа водорода. Например, реакция между холодной разбавленной Н2SO4 (в предположении ее полной двухэтапной диссоциации) и металлическим цинком выглядит так:
Zn + Н2SO4 =ZnSO4 + H2.
Горячая серная кислота концентрированная, плотность которой около 1,8 г/см3, может действовать в качестве окислителя, реагируя с материалами, которые обычно инертны к кислотам, такими, например, как металлическая медь. В процессе реакции медь окисляется, а масса кислоты уменьшается, образуется раствор сульфата меди (II) в воде и газообразная двуокись серы (SO2) вместо водорода, чего можно было бы ожидать при взаимодействии кислоты с металлом.
Cu + 2Н2SO4 = CuSO4 + SO2 + 2H2 O.

Как вообще выражается концентрация растворов
Собственно, концентрация любого раствора может быть выражена различными способами, но наиболее широко используется весовая концентрация. Она показывает количество граммов растворенного вещества в определенной массе или объеме раствора или растворителя (обычно 1000 г, 1000 см3, 100 см3 и 1 дм3). Вместо массы вещества в граммах можно брать его количество, выраженное в молях, – тогда получается молярная концентрация на 1000 г или 1 дм3 раствора.
Если молярная концентрация определена по отношению не к количеству раствора, а только к растворителю, то она носит название моляльности раствора. Для нее характерна независимость от температуры.
Зачастую весовую концентрацию указывают в граммах на 100 г растворителя. Умножая этот показатель на 100 %, получают ее в весовых процентах (процентная концентрация). Именно этот способ является наиболее часто употребляемым в применении к растворам серной кислоты.
Каждой величине концентрации раствора, определенной при данной температуре, соответствует вполне конкретная его плотность (например, плотность раствора серной кислоты). Поэтому иногда раствор характеризуют именно ею. Например, раствор Н2SO4, характеризующийся процентной концентрацией 95,72 %, имеет плотность 1,835 г/см3 при t = 20 °С. Как же определить концентрацию такого раствора, если дана только плотность серной кислоты? Таблица, дающая такое соответствие, является неотъемлемой принадлежностью любого учебника по общей или аналитической химии.
Пример пересчета концентрации
Попробуем перейти от одного способа выражения концентрации раствора к другому. Предположим, что мы имеем раствор Н2SO4в воде с процентной концентрацией 60 %. Сначала определим соответствующую плотность серной кислоты. Таблица, содержащая процентные концентрации (первый столбец) и соответствующие им плотности водного раствора Н2SO4 (четвертый столбец), приведена ниже.
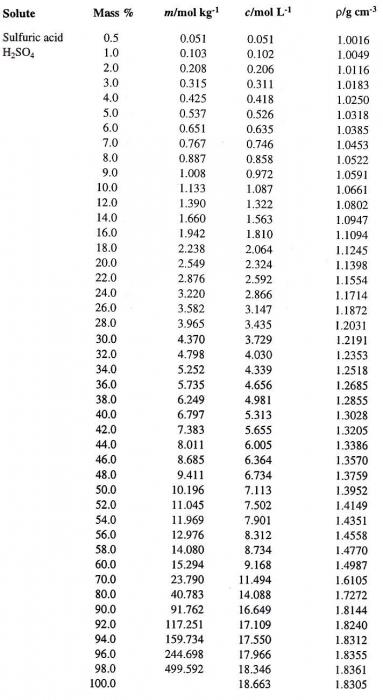
По ней определяем искомую величину, которая равна 1,4987 г/см3. Вычислим теперь молярность данного раствора. Для этого необходимо определить массу Н2SO4в 1 л раствора и соответствующее ей число молей кислоты.
Объем, который занимают 100 г исходного раствора:
100 / 1,4987 = 66,7 мл.
Так как в 66,7 миллилитрах 60%-ного раствора содержится 60 г кислоты, то в 1 л ее будет содержаться:
(60 / 66,7) х 1000 = 899, 55 г.
Молярный вес серной кислоты равен 98. Отсюда число молей, содержащихся в 899,55 г ее граммах, будет равно:
899,55 / 98 = 9,18 моль.
Зависимость плотности серной кислоты от концентрации приведена на рис. ниже.
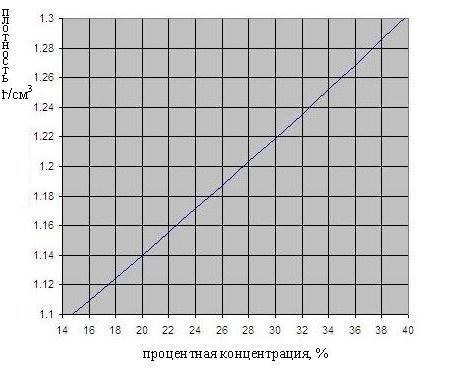
Использование серной кислоты
Она применяется в различных отраслях промышленности. В производстве чугуна и стали она используется для очистки поверхности металла, прежде чем он покрывается другим веществом, участвует в создании синтетических красителей, а также других типов кислот, таких как соляная и азотная. Она также применяется в производстве фармпрепаратов, удобрений и взрывчатых веществ, а еще является важным реагентом при удалении примесей из нефти в нефтеперерабатывающей промышленности.
Это химическое вещество является невероятно полезным и в быту, и легко доступно как раствор серной кислоты, используемый в свинцово-кислотных аккумуляторных батареях (например, тех, что стоят в автомобилях). Такая кислота, как правило, имеет концентрацию примерно от 30% до 35% H2SO 4 по весу, остальное — вода.
Для многих бытовых приложений 30% Н2SO4 будет более чем достаточно, чтобы удовлетворить свои потребности. Однако в промышленности требуется и значительно более высокая концентрация серной кислоты. Обычно в процессе производства она сначала получается достаточно разбавленной и загрязненной органическими включениями. Концентрированную кислоту получают в два этапа: сначала ее доводят до 70 %, а затем — на втором этапе — поднимают до 96-98 %, что является предельным показателем для экономически рентабельного производства.
Плотность серной кислоты и ее сорта
Хотя почти 99%-ную серную кислоту можно получить кратковременно при кипении, но последующая потеря SO3 в точке кипения приводит к снижению концентрации до 98,3%. Вообще, разновидность с показателем 98% более устойчива в хранении.
Товарные сорта кислоты различаются по ее процентной концентрации, причем для них выбраны те ее значения, при которых минимальны температуры кристаллизации. Это сделано для уменьшения выпадения кристаллов серной кислоты в осадок при транспортировке и хранении. Основные сорта таковы:
- Башенная (нитрозная) — 75 %. Плотность серной кислоты этого сорта равна 1670 кг/м3. Получают его т.наз. нитрозным методом, при котором получаемый при обжиге первичного сырья обжиговый газ, содержащий двуокись серы SO2, в футерованных башнях (отсюда и название сорта) обрабатывают нитрозой (это тоже H2SO4, но с растворенными в ней оксидами азота). В результате выделяются кислота и оксиды азота, которые не расходуются в процессе, а возвращаются в производственный цикл.
- Контактная — 92,5-98,0 %. Плотность серной кислоты 98%-ной этого сорта равна 1836,5 кг/м3. Получают ее также из обжигового газа, содержащего SO2, причем процесс включает окисление двуокиси до ангидрида SO3 при ее контакте (отсюда и название сорта) с несколькими слоями твердого ванадиевого катализатора.
- Олеум — 104,5 %. Плотность его равна 1896,8 кг/м3. Это раствор SO3 в H2SO4, в котором первого компонента содержится 20 %, а кислоты — именно 104,5 %.
- Высокопроцентный олеум — 114,6 %. Его плотность – 2002 кг/м3.
- Аккумуляторная — 92-94 %.
Как устроен автомобильный аккумулятор
Работа этого одного из самых массовых электротехнических устройств полностью основана на электрохимических процессах, происходящих в присутствии водного раствора серной кислоты.
Автомобильный аккумулятор содержит разбавленный серно-кислотный электролит, а также положительный и отрицательный электроды в виде нескольких пластин. Положительные пластины выполнены из красновато-коричневого материала — диоксида свинца (PbO2), а отрицательные — из сероватого «губчатого» свинца (Pb).
Поскольку электроды изготовлены из свинца или свинцовосодержащего материала, то этот тип батареи часто называют свинцово-кислотным аккумулятором. Работоспособность его, т. е. величина выходного напряжения, напрямую определяется тем, какова в данный момент времени плотность серной кислоты (кг/м3 или г/см3), залитой в аккумулятор в качестве электролита.
Что происходит с электролитом при разряде аккумулятора
Электролит свинцово-кислотного аккумулятора представляет собой раствор аккумуляторной серной кислоты в химически чистой дистиллированной воде с процентной концентрацией по 30 % при полной зарядке. Чистая кислота имеет плотность 1,835 г/см3, электролит – около 1,300 г/см3. Когда аккумулятор разряжается, в нем происходят электрохимические реакции, в результате которых из электролита отбирается серная кислота. Плотность от концентрации раствора зависит практически пропорционально, поэтому она должна уменьшаться вследствие снижения концентрации электролита.
До тех пор, пока ток разряда протекает через аккумулятор, кислота вблизи его электродов активно используется, и электролит становится все более разбавленным. Диффузия кислоты из объема всего электролита и к электродным пластинам поддерживает примерно постоянную интенсивность химических реакций и, как следствие, выходное напряжение.
В начале процесса разряда диффузия кислоты из электролита в пластины происходит быстро потому, что образующийся при этом сульфат еще не забил поры в активном материале электродов. Когда сульфат начинает формироваться и заполнять поры электродов, диффузия происходит более медленно.
Теоретически можно продолжить разряд до тех пор, пока все кислота не будет использована, и электролит будет состоять из чистой воды. Однако опыт показывает, что разряды не должны продолжаться после того, как плотность электролита упала до 1,150 г/см3.
Когда плотность падает от 1,300 до 1,150, это означает, что столько сульфата было сформировано в процессе реакций, и он заполняет все поры в активных материалах на пластинах, т. е. из раствора уже отобрана почти вся серная кислота. Плотность от концентрации зависит пропорционально, и точно так же от плотности зависит заряд аккумулятора. На рис. ниже показана зависимость заряда аккумулятора от плотности электролита.
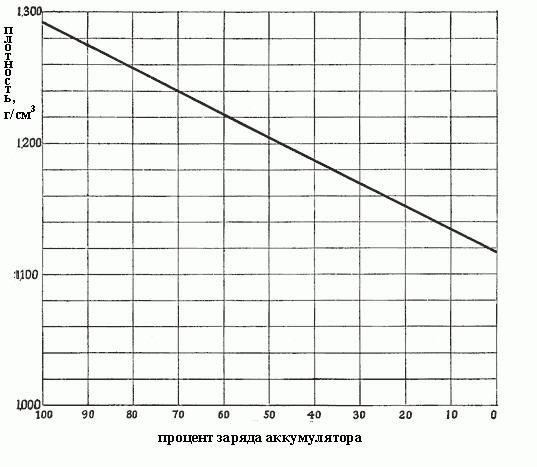
Изменение плотности электролита является лучшим средством определения состояния разряда аккумулятора, при условии, что он используется надлежащим образом.
Степени разряда автомобильного аккумулятора в зависимости от плотности электролита
Плотность его должна измеряться каждые две недели и постоянно должна вестись запись показаний для использования в будущем.
Чем плотнее электролит, тем больше кислоты он содержит, и тем более заряжен аккумулятор. Плотность в 1,300-1,280 г/см3 указывает на полный заряд. Как правило, различаются следующие степени разряда аккумулятора в зависимости от плотности электролита:
- 1,300-1,280 – полностью заряжен:
- 1,280-1,200 – более чем наполовину разряжен;
- 1,200-1,150 – заряжен менее чем наполовину;
- 1,150 – практически разряжен.
У полностью заряженного аккумулятора перед подключением его автомобильной сети напряжение каждой ячейки составляет от 2,5 до 2,7 В. Как только подключается нагрузка, напряжение быстро падает примерно до 2,1 В в течение трех или четырех минут. Это происходит из-за формирования тонкого слоя сульфата свинца на поверхности отрицательных электродных пластин и между слоем перекиси свинца и металлом положительных пластин. Окончательное значение напряжения ячейки после подключения к автомобильной сети составляет около 2,15-2,18 вольт.
Когда ток начинает протекать через аккумулятор в течение первого часа работы, происходит падение напряжения до 2 В, объясняемое ростом внутреннего сопротивления ячеек из-за формирования большего количества сульфата, который заполняет поры пластин, и отбора кислоты из электролита. Незадолго до начала протекания тока плотность электролита максимальна и равна 1,300 г/см3. Поначалу его разрежение происходит быстро, но затем устанавливается сбалансированное состояние между плотностью кислоты вблизи пластин и в основном объеме электролита, отбор кислоты электродами поддерживается поступлением новых частей кислоты от основной части электролита. При этом средняя плотность электролита продолжает неуклонно уменьшаться по зависимости, показанной на рис. выше. После первоначального падения напряжение уменьшается более медленно, скорость его снижения зависит от нагрузки аккумулятора. Временной график процесса разряда показан на рис. ниже.
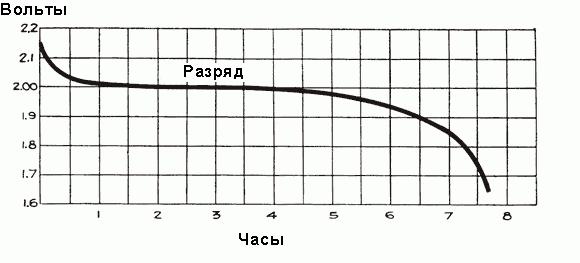
Контроль состояния электролита в аккумуляторе
Для определения плотности используется ареометр. Он состоит из небольшой запаянной стеклянной трубки с расширением на нижнем конце, заполненным дробью или ртутью, и градуированной шкалой на верхнем конце. Эта шкала помечена от 1,100 до 1,300 с различными промежуточными значениями, как показано на рис. ниже. Если этот ареометр помещается в электролит, то он будет опускаться до определенной глубины. При этом он будет вытеснять определенный объем электролита, и когда будет достигнуто равновесное положение, вес вытесненного объема просто будет равен весу ареометра. Поскольку плотность электролита равна отношению его веса к объему, а вес ареометра известен, то каждый уровень его погружения в раствор соответствует определенной его плотности.
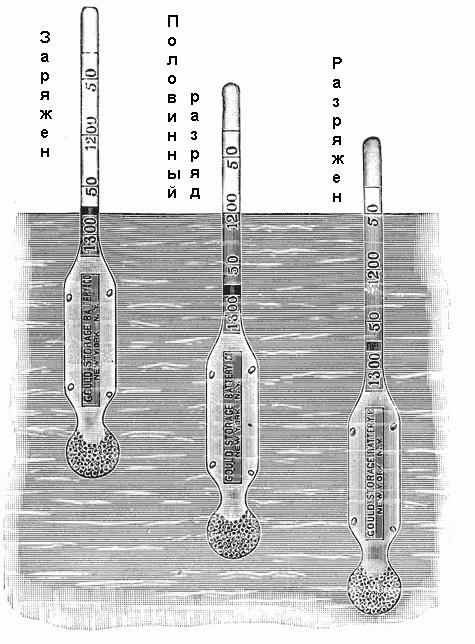 Некоторые ареометры не имеют шкалы со значениями плотности, но помечены надписями: «Заряжен», «Половинный разряд», «Полный разряд» или им подобными.
Некоторые ареометры не имеют шкалы со значениями плотности, но помечены надписями: «Заряжен», «Половинный разряд», «Полный разряд» или им подобными.Электролит свинцово-кислотной аккумуляторной батареи.
Электролит
Для работы свинцово-кислотной аккумуляторной батареи необходим электролит – водный раствор серной кислоты, обладающий высокой ионной проводимостью. При погружении электродов аккумулятора в электролит и подключении к выводам электродов внешней нагрузки начинаются электрохимические реакции, описанные в предыдущей статье.
Электролит для заливки в аккумуляторную батарею готовят из серной кислоты (ГОСТ 667-73) и дистиллированной воды (ГОСТ 6709-72). При подготовке электролита следует пользоваться руководством по эксплуатации автомобиля. Для надежной работы аккумуляторных батарей необходима высокая степень чистоты электролита.
Нельзя применять техническую серную кислоту и недистиллированную воду, так как при этом ускоряется саморазрядка, сульфатация и разрушение пластин, и уменьшается емкость батареи.
При приготовлении электролита кислоту льют тонкой струйкой в воду, одновременно помешивая раствор чистой стеклянной палочкой. Нельзя наливать воду в кислоту, так как при этом выделяется большое количество тепла в верхних слоях раствора, и электролит будет разбрызгиваться из емкости и при попадании на тело может вызвать ожоги.
Смешивать электролит следует в кислотостойкой эбонитовой, фарфоровой или освинцованной посуде.
Количество дистиллированной воды, серной кислоты или электролита при приготовлении 1 литра электролита необходимой плотности приведены в таблице 1.
Таблица 1. Количество дистиллированной воды, серной кислоты или электролита плотностью 1,4 г/см3 для приготовления 1 л электролита необходимой плотности при температуре 25 ˚С, л
Плотность |
Для серной кислоты |
Для электролита |
||
дистиллированная |
серная кислота |
дистиллированная |
электролит |
|
1,23 |
0,829 |
0,231 |
0,465 |
0,549 |
1,25 |
0,809 |
0,253 |
0,410 |
0,601 |
1,27 |
0,791 |
0,274 |
0,357 |
0,652 |
1,31 |
0,749 |
0,319 |
0,246 |
0,760 |
1,40 |
0,650 |
0,423 |
0 |
1 |
Плотность электролита определяют с помощью денсиметра или ареометра.
Новые аккумуляторные батареи заливают электролитом плотностью на 0,02 г/см3 меньше той, которая должна быть в конце зарядки.
***
Плотность электролита
Плотность электролита, как и любого другого вещества, определяется отношением массы к занимаемому этой массой объему. Для электролита плотность измеряется в граммах на кубический сантиметр (г/см3).
Поскольку плотность дистиллированной воды равна 1 г/см3, а серная кислота тяжелее воды (ее плотность при +20 ˚С составляет: 1,8312-1,8355 г/см3), то с добавлением серной кислоты в воду плотность электролита будет возрастать, а при добавлении в раствор (электролит) воды, его плотность будет уменьшаться. По этим же причинам плотность будет уменьшаться при сульфатации пластин и при сильной разрядке батареи, а увеличивается при испарении воды (например, в процессе интенсивной зарядки).
При понижении плотности электролита возрастает внутреннее сопротивление аккумуляторной батареи и уменьшается ее емкость. В морозное время года чрезмерное снижение плотности может привести к замерзанию электролита.
Повышение плотности электролита приводит к интенсивному разрушению пластин и их сульфатации, что снижает емкость аккумулятора и уменьшает срок его службы. Следует учитывать, что плотность электролита в аккумуляторах (банках) аккумуляторной батареи не должна отличаться более чем на 0,01 г/см3. В противном случае батарею необходимо полностью зарядить и произвести корректирование плотности электролита.
Если плотность выше нормы — доливают дистиллированную воду, если ниже — электролит плотностью 1,4 г/см3 (электролит можно доливать лишь в полностью заряженную аккумуляторную батарею). Корректировку плотности доливкой производят после предварительного отбора из аккумуляторов нужного количества электролита. После этого аккумуляторную батарею заряжают в течение 25…30 мин для полного перемешивания электролита и снова измеряют его плотность.
В процессе эксплуатации необходимо следить за состоянием аккумуляторной батареи. При нормальных эксплуатационных параметрах плотность электролита в аккумуляторах батареи является индикатором степени их разрядки. Снижение плотности электролита на 0,01 г/см3 соответствует разрядке аккумулятора на 6 %.
Если появляется необходимость в частой подзарядке батареи, следует выяснить причину и ее устранить, поскольку систематическая недозарядка аккумуляторной батареи значительной сокращает срок ее службы и отрицательно сказывается на пусковых качествах двигателя.
***
Определение степени зарядки аккумуляторной батареи
Степень зарядки аккумуляторной батареи проверяют измерением плотности электролита, приведенной к температуре +25 ˚С. В зависимости от климатических условий эксплуатации автомобиля и времени года используется электролит разной плотности (таблица 2).
Таблица 2. Плотность электролита в зависимости от климатических условий и времени года
Макрокли- |
Климатический район (ГОСТ 16350-80) |
Средне- |
Время года |
Плотность электролита приведенная к температуре +25 ˚С, г/см3 |
|
Для новой аккумуляторной батареи |
Для заряженной аккумуляторной батареи |
||||
Холодный |
Очень холодный |
от -50 до -30 |
Зима |
1,28 |
1,30 |
Лето |
1,24 |
1,26 |
|||
Холодный |
от -30 до -15 |
Круглый год |
1,26 |
1,28 |
|
Умеренный |
Умеренный |
от -15 до -3 |
Круглый год |
1,24 |
1,26 |
Жаркий сухой |
от -15 до +4 |
1,22 |
1,24 |
||
Теплый влажный |
0 до +4 |
1,20 |
1,22 |
||
При определении плотности электролита необходимо учитывать его температуру, применяя соответствующие поправки, приведенные в таблице 3.
Таблица 3. Поправки при измерении плотности электролита (г/см3) в зависимости от его температуры
Температура электролита, |
+45 |
+30 |
+15 |
0 |
-30 |
-15 |
-45 |
Поправка плотности |
+0,02 |
+0,01 |
0 |
-0,01 |
-0,02 |
-0,03 |
-0,04 |
***
Проверка уровня электролита
Одним из важнейших условий надежной работы аккумуляторной батареи является поддержание необходимого уровня электролита в ее элементах. Уровень электролита в каждой секции моноблока (банках) должен быть на 10…15 мм выше предохранительного щитка, установленного над сепараторами.
Для облегчения контроля уровня электролита у заливных горловин аккумуляторных батарей снизу имеются указатели – тубусы, входящие внутрь аккумуляторной батареи. Нижний срез тубуса находится на требуемом расстоянии от поверхности предохранительного щитка. Уровень электролита считается достаточным, если поверхность электролита касается нижнего торца тубуса горловины. При этом на поверхности электролита образуется четко видимый мениск. Если уровень электролита ниже указанного из-за выплескивания, следует долить дистиллированной воды.
Проверять уровень электролита рекомендуется на остывшей заряженной аккумуляторной батарее или после длительной поездки, так как в этом случае происходит «кипение» электролита, повышение его температуры и испарение дистиллированной воды.
В случае превышения уровня электролита в банках аккумуляторной батареи его следует уменьшить с помощью резиновой груши, так как выплескивание может привести к интенсивной коррозии деталей крепления и к окислению проводов.
***
Типы автомобильных аккумуляторов
