Октан что это: Октан — это… Что такое Октан? – Октан (значения) — Википедия
- 03.09.2020
Определение октан общее значение и понятие. Что это такое октан
Понятие октана, которое также известно как октановое число, относится к количеству октана, присутствующего в топливе . Поэтому, чтобы понять, что такое октан, мы должны знать значение октана и топлива.
Хотя в коммерческой области это обычно считается одним октановым числом, в международных технических спецификациях присутствуют два значения, которые служат для измерения поведения бензина в двух разных ситуациях:* RON ( октановое число исследований ) : это часто встречается на станциях техобслуживания и приблизительно отражает поведение бензина в городе, учитывая большое количество необходимых ускорений. для городских поездок, учитывая многочисленные паузы, которые предполагают семафоры и другие элементы;
* MON ( октановое число двигателя или октановое число двигателя ) : это значение получается из октанового числа в статическом двигателе и стремится воспроизвести ситуацию, которая возникает на шоссе, где оно регулярно движется и не имеет много прерываний.
Существует несколько технологий, разработанных во всем мире для улучшения октанового числа различных видов топлива, хотя выделяются следующие: избегание добавок в бензин с помощью новых методов каталитического риформинга, изомеризации и рафинирования, среди других процессов что значительно снижает или исключает необходимость использования тетраэтилсвинца; создание экологических добавок, таких как метил-трет-бутиловый эфир (MTBE) и этил-трет-бутиловый эфир (ETBE), которые заменяют сильно загрязняющий тетраэтилсвинец, повышают октановое число и придают топливу повышение оксигенации, улучшение сгорания и
Одним словом, октан отражает качество топлива . Если топливо имеет высокое октановое число, преждевременные детонации будут предотвращены, а выделение полезной энергии будет увеличено.
|
|
ОКТАНЫ (от греч.
— восемь)
С8Н18, мол. м. 114,224. Существует 18 изомерных октанов.
В статье описаны нормальный октан СН3(СН2)6СН3
и изооктан (СН Октаны-типичные алифатич. углеводороды. При пиролизе октана образуются в осн. метан, этан, этилен; при крекинге на алюмосиликатном катализаторе возрастает выход углеводородов С3-С5; в присут. ароматизирующих катализаторов (Pt/C, оксиды Сг НЕКОТОРЫЕ СВОЙСТВА ОКТАНОВ
Октан содержится в бензиновой
фракции нефти и продуктах ее деструктивной переработки, в алкилате, образуется
при синтезе углеводородов по методу Фишера-Тропша. В пром-сти его выделяют из
указанных продуктов ректификацией в сочетании с селективной адсорбцией на цеолитах
или комплексообразованием с мочевиной. В лаб. условиях получают гидрированием
октенов, по р-ции Вюрца из 1-хлорбутана и др. Технически чистый изооктан
получают димеризацией изобутилена с послед. гидрированием на никелевом или медно-хромовом
катализаторе. При алккилировании изобутана изобутиленом в присут. H2SO4,
HF или др. кислотных катализаторов получают техн. изооктан, содержащий значит.
кол-ва изомерных октанов разветвленного строения и продуктов полиалкилирования
(т-ра выкипания 98-185 °С, октановое число 92-97). Применяют октан в произ-ве
ксилолов, октанола, окта-наля, а также как р-ритель. Как компонент бензина большого
значения не имеет из-за низкой детонац. стойкости (октановое число 19). Применение
изооктана обусловлено его
высокой детонац. стойкостью (октановое число принято за 100). Технически чистый
изооктан используется в качестве первичного эталонного топлива для определения
сортности бензина, технический-как компонент авиац. бензинов. Хим. превращ.
изооктана практич. значения не имеют. Октаны легко воспламеняются,
в смеси с воздухом взрывоопасны. Нетоксичны, не обладают аллергенными и канцерогенными
св-вами. Лит.: Петров Ал.
А., Химия алканов, М., 1974. А. А. Братков. |
Октан — Вікіпедія
Матеріал з Вікіпедії — вільної енциклопедії.
Окта́н (від грец. octa — вісім) — насичений вуглеводень (алкан) складу C8H18. Молекулярна маса — 114,224. Має 18 ізомерів.
Октан — безбарвна рідина зі слабким запахом прямогонного бензину, необмежено змішується з вуглеводнями, погано розчинний у діетиловому ефірі, ацетоні і етанолі, практично не розчинний у воді. Октани легко запалюються, в суміші з повітрям вибухонебезпечні. Нетоксичні, не мають алергенних і канцерогенних властивостей.
Октан має 18 структурних ізомерів:
- Октан (н-октан)
- 2-Метилгептан
- 3-Метилгептан (+ має оптичну ізомерію)
- 4-Метилгептан
- 3-Етилгексан
- 2,2-Диметилгексан
- 2,3-Диметилгексан (+ має оптичну ізомерію)
- 2,4-Диметилгексан (+ має оптичну ізомерію)
- 2,5-Диметилгексан
- 3,3-Диметилгексан
- 3,4-Диметилгексан (+ має оптичну ізомерію (два хиральних центри))
- 2-Метил-3-етилпентан
- 3-Метил-3-етилпентан
- 2,2,3-Триметилпентан (+ має оптичну ізомерію)
- 2,2,4-Триметилпентан (також відомий як ізооктан)
- 2,3,3-Триметилпентан
- 2,3,4-Триметилпентан
- 2,2,3,3-Тетраметилбутан
Октан міститься в бензиновій фракції нафти та продуктах її деструктивної переробки, в алкілаті, утворюється при синтезі вуглеводнів за процесом Фішера-Тропша. У промисловості його виділяють із зазначених продуктів ректифікацією у поєднанні з селективною адсорбцією на цеолітах або комплексоутворенням з сечовиною. У лабораторних умовах отримують гідруванням октенів, за реакцією Вюрца з 1-хлорбутану.
При піролізі октану утворюються в основному метан, етан, етилен; при крекінгу на алюмосилікатному каталізаторі зростає вихід вуглеводнів С3-С5; у присутності ароматизуючих каталізаторів (Pt/C, оксидів Cr, Mo, V на Al2O3) при 450—500 °C з високим виходом утворюється суміш о-ксилену і стирену.
Застосовують октан у виробництві ксиленів, октанолу, октаналю, а також як розчинник. Як компонент бензину великого значення не має через низьку детонаційну стійкість (октанове число 19).
- Петров Ал. А. Химия алканов. — : Наука. — 1974. — 243 с.
Алканы — Википедия
Эта статья — о химических соединениях. О канадской алюминиевой компании см. Rio Tinto Alcan.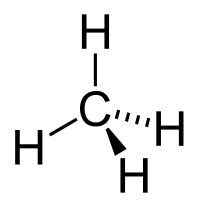 |
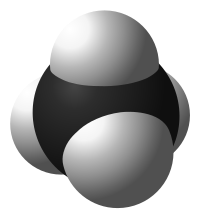 |
| Химическая структура (вверху) и 3D-модель (внизу) метана — простейшего алкана |
Алка́ны (также насыщенные углеводороды, парафины) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Все алканы относятся к более крупному классу алифатических углеводородов. Алканы являются насыщенными углеводородами, то есть содержат максимально возможное число атомов водорода для заданного числа атомов углерода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109°28′. Связи C—C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью. Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,1087 нм.
Простейшим представителем класса является метан (CH4). Углеводород с самой длинной цепью — нонаконтатриктан C390H782 синтезировали в 1985 году английские химики И. Бидд и М. К. Уайтинг[1].
Рациональная[править | править код]
Выбирается один из атомов углеродной цепи, он считается замещённым метаном, и относительно него строится название «алкил1алкил2алкил3алкил4метан», например:
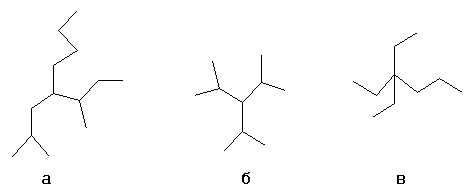
- а: н-бутил-втор-бутилизобутилметан
- б: триизопропилметан
- в: триэтилпропилметан
- б: триизопропилметан
Систематическая ИЮПАК[править | править код]
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь, при этом нумерация этой цепи начинается со стороны ближайшего к концу цепи заместителя. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.[2]
Например:
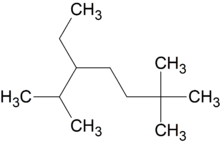 2,6,6-триметил-3-этилгептан (слева направо) / 2,2,6-триметил-5-этилгептан (справа налево)
2,6,6-триметил-3-этилгептан (слева направо) / 2,2,6-триметил-5-этилгептан (справа налево)При сравнении положений заместителей в обеих комбинациях, предпочтение отдается той, в которой первая отличающаяся цифра является наименьшей. Таким образом, правильное название — 2,2,6-триметил-5-этилгептан.
Алканы образуют гомологический ряд.
| Гомологический ряд алканов (первые 10 членов) | ||
|---|---|---|
| Метан | CH4 | CH4 |
| Этан | CH3—CH3 | C2H6 |
| Пропан | CH3—CH2—CH3 | C3H8 |
| Бутан | CH3—CH2—CH2—CH3 | C4H10 |
| Пентан | CH3—CH2—CH2—CH2—CH3 | C5H12 |
| Гексан | CH3—CH2—CH2—CH2—CH2—CH3 | C6H14 |
| Гептан | CH3—CH2—CH2—CH2—CH2—CH2—CH3 | C7H16 |
| Октан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C8H18 |
| Нонан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C9H20 |
| Декан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C10H22 |
Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета, а начиная с C7H16 — также оптической изомерией[3]. Число структурных изомеров алканов CnH2n+2 в зависимости от числа атомов углерода n без учёта стереоизомерии[4][5] и с учётом стереоизомерии[6]:
| n | Число изомеров | С учётом стереоизомерии |
|---|---|---|
| 4 | 2 | 2 |
| 5 | 3 | 3 |
| 6 | 5 | 5 |
| 7 | 9 | 11 |
| 8 | 18 | 24 |
| 9 | 35 | 55 |
| 10 | 75 | 136 |
| 11 | 159 | 345 |
| 12 | 355 | 900 |
| 13 | 802 | 2412 |
| 14 | 1858 | 6563 |
| 15 | 4347 | 18 127 |
| 20 | 366 319 | 3 396 844 |
| 25 | 36 797 588 | 749 329 719 |
| 30 | 4 111 846 763 | 182 896 187 256 |
Число структурных изомеров низших углеводородов до C14H30 было установлено прямым подсчётом; в 1931 году был разработан рекурсивный метод подсчёта числа изомеров[7]. Какой-либо простой связи между числом атомов углерода n и числом изомеров обнаружено не было[7]. При n→1{\displaystyle n\rightarrow {\mathcal {1}}} число различных структурных изомеров алканов можно оценить посредством теоремы Редфилда — Пойи[8].
- Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
- При стандартных условиях, установленных ИЮПАК (давление 105 Па, температура 0 °C), неразветвлённые алканы с CH4 до C4H10 являются газами, с C5H12 до C13H28 — жидкостями, а начиная с C14H30 и далее — твёрдыми веществами.
- Температуры плавления и кипения понижаются от менее разветвлённых к более разветвлённым. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
- Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
| n | Название | Тпл, °C | Ткип, °C | Плотность, г/см³ | Показатель преломления |
|---|---|---|---|---|---|
| 1 | Метан | −182,48 | −161,5 | 0,416 при Tкип | |
| 2 | Этан | −183,3 | −88,63 | 0,546 при Tкип | |
| 3 | Пропан | −187,7 | −42,1 | 0,585 при Tкип | |
| 4 | Бутан | −138,35 | −0,5 | 0,6 при Tкип | 1,3326 |
| Изобутан | −159,60 | −11,73 | 0,5510 при Tкип | ||
| 5 | Пентан | −129,7 | 36,07 | 0,6262 | 1,3575 |
| 6 | Гексан | −95,3 | 68,7 | 0,6594 | 1,3749 |
| 7 | Гептан | −90,6 | 98,4 | 0,638 | 1,3876 |
| 8 | Октан | −55,8 | 125,7 | 0,7025 | 1,3974 |
| 9 | Нонан | −54 | 150,8 | 0,718 | 1,4054 |
| 10 | Декан | −29,7 | 174,1 | 0,730 | 1,4119 |
| 11 | Ундекан | −25,6 | 195,9 | 0,7402 | 1,4151 |
| 12 | Додекан | −9,6 | 216,3 | 0,7487 | 1.4216 |
| 13 | Тридекан | −5,4 | 235,5 | 0,7564 | 1,4256 |
| 14 | Тетрадекан | 5,9 | 253,6 | 0,7628 | 1,4289 |
| 15 | Пентадекан | 9,9 | 270,6 | 0,7685 | 1,4310 |
| 16 | Гексадекан | 18,2 | 286,8 | 0,7734 | 1,4345 |
| 17 | Гептадекан | 22,0 | 301,9 | 0,778* | 1,4369* |
| 18 | Октадекан | 28,2 | 316,1 | 0,7819* | 1,4390* |
| 19 | Нонадекан | 32,1 | 329,76 | 0,7855* | 1,4409* |
| 20 | Эйкозан | 36,8 | 342,7 | 0,7887* | 1,4426* |
| 21 | Генэйкозан | 40,5 | 355,1 | 0,7917* | 1,4441* |
| 22 | Докозан | 44,4 | 367,0 | 0,7944* | 1,4455* |
| 23 | Трикозан | 47,6 | 378,3 | 0,7969* | 1,4468* |
| 24 | Тетракозан | 50,9 | 389,2 | 0,7991* | 1,4480* |
| 25 | Пентакозан | 53,7 | 399,7 | 0,8012* | 1,4491* |
| 26 | Гексакозан | 57 | 262 (15 мм рт. ст.) | 0,778 | |
| 27 | Гептакозан | 60 | 270 (15 мм рт. ст.) | 0,780 | |
| 28 | Октакозан | 61,1 | 280 (15 мм рт. ст.) | 0,807 | |
| 29 | Нонакозан | 64 | 286 (15 мм рт. ст.) | 0,808 | |
| 30 | Триаконтан | 65,8 | 446,4 | 0,897* | 1,4536* |
| 31 | Гентриаконтан | 67,9 | 455 | 0,8111* | 1,4543* |
| 32 | Дотриаконтан | 69,7 | 463 | 0,8124* | 1,4550* |
| 33 | Тритриаконтан | 71 | 474 | 0,811 | |
| 34 | Тетратриаконтан | 73,1 | 478 | 0,8148* | 1,4563* |
| 35 | Пентатриаконтан | 74,7 | 486 | 0,8159* | 1,4568* |
| 36 | Гексатриаконтан | 75 | 265 при 130 Па | 0,814 | |
| 37 | Гептатриаконтан | 77,4 | 504,14 | 0,815 | |
| 38 | Октатриаконтан | 79 | 510,93 | 0,816 | |
| 39 | Нонатриаконтан | 78 | 517,51 | 0,817 | |
| 40 | Тетраконтан | 81,4 | 523,88 | 0,817 | |
| 41 | Гентетраконтан | 80,7 | 530,75 | 0,818 | |
| 42 | Дотетраконтан | 82,9 | 536,07 | 0,819 | |
| 43 | Тритетраконтан | 85,3 | 541,91 | 0,820 | |
| 44 | Тетратетраконтан | 86,4 | 547,57 | 0,820 | |
| 45 | Пентатетраконтан | 553,1 | 0,821 | ||
| 46 | Гексатетраконтан | 558,42 | 0,822 | ||
| 47 | Гептатетраконтан | 563,6 | 0,822 | ||
| 48 | Октатетраконтан | 568,68 | 0,823 | ||
| 49 | Нонатетраконтан | 573,6 | 0,823 | ||
| 50 | Пентаконтан | 93 | 421 | 0,824 | |
| 51 | Генпентаконтан | 583 | 0,824 | ||
| 52 | Допентаконтан | 94 | 587,6 | 0,825 | |
| 53 | Трипентаконтан | 592 | 0,825 | ||
| 54 | Тетрапентаконтан | 95 | 596,38 | 0,826 | |
| … | … | … | … | … | … |
| 60 | Гексаконтан | 98,9 | |||
| … | … | … | … | … | … |
| 70 | Гептаконтан | 105,3 | |||
| … | … | … | … | … | … |
| 100 | Гектан | 115,2 | |||
| … | … | … | … | … | … |
| 150 | Пентаконтагектан | 123 | |||
| … | … | … | … | … | … |
| 390 | Нонаконтатриктан | 132 |
Примечание к таблице: * отмечены значения, полученные для переохлаждённой жидкости.
ИК-спектроскопия[править | править код]
В ИК-спектрах алканов четко проявляются частоты валентных колебаний связи С—Н в области 2850—3000 см−1. Частоты валентных колебаний связи С—С переменны и часто малоинтенсивны. Характеристические деформационные колебания в связи С—Н в метильной и метиленовой группах обычно лежат в интервале 1400—1470 см−1, однако метильная группа даёт в спектрах слабую полосу при 1380 см−1.
УФ-спектроскопия[править | править код]
Чистые алканы не поглощают излучение в ультрафиолетовой области выше 2000 Å и по этой причине часто оказываются отличными растворителями для снятия УФ-спектров других соединений.
Алканы имеют низкую химическую активность. Это объясняется тем, что одинарные связи C—H и C—C относительно прочны, и их сложно разрушить. Поскольку связи С—C неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.
Реакции радикального замещения[править | править код]
Галогенирование[править | править код]
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-излучением или нагреть.
Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от хлорметана до тетрахлорметана. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного, и в 2 раза меньше, чем вторичного. Таким образом, хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Стоит отметить, что галогенирование происходит тем легче, чем длиннее углеродная цепь н-алкана. В этом же направлении уменьшается энергия ионизации молекулы вещества, то есть, алкан легче становится донором электрона.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно с последовательным образованием хлорметана, дихлорметана, хлороформа и тетрахлорметана: за один этап замещается не более одного атома водорода:
- Ch5+Cl2→Ch4Cl+HCl{\displaystyle {\mathsf {CH_{4}+Cl_{2}\rightarrow CH_{3}Cl+HCl}}}
- Ch4Cl+Cl2→Ch3Cl2+HCl{\displaystyle {\mathsf {CH_{3}Cl+Cl_{2}\rightarrow CH_{2}Cl_{2}+HCl}}}
- Ch3Cl2+Cl2→CHCl3+HCl{\displaystyle {\mathsf {CH_{2}Cl_{2}+Cl_{2}\rightarrow CHCl_{3}+HCl}}}
- CHCl3+Cl2→CCl4+HCl{\displaystyle {\mathsf {CHCl_{3}+Cl_{2}\rightarrow CCl_{4}+HCl}}}
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, отрывая у них атом водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Цепной механизм галогенирования:
1) Инициирование
- Cl:Cl→hνCl·+·Cl{\displaystyle {\ce {\mathsf {Cl{\text{:}}Cl->[{h\nu }]Cl{\text{·}}+{\text{·}}Cl}}}}
2) Рост цепи
- Ch4-Ch3-Ch4+Cl·→Ch4-CH˙-Ch4+HCl{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{3}+Cl{\text{·}}\rightarrow CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+HCl}}}
- Ch4-CH˙-Ch4+Cl:Cl→Ch4-CHCl-Ch4+Cl·{\displaystyle {\mathsf {CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+Cl{\text{:}}Cl\rightarrow CH_{3}{\text{-}}CHCl{\text{-}}CH_{3}+Cl{\text{·}}}}}
3) Обрыв цепи
- Ch4-CH˙-Ch4+Cl·→Ch4-CHCl-Ch4{\displaystyle {\mathsf {CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+Cl{\text{·}}\rightarrow CH_{3}{\text{-}}CHCl{\text{-}}CH_{3}}}}
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором и хлором реакция может протекать со взрывом, в таких случаях галоген разбавляют азотом или подходящим растворителем.
Сульфирование[править | править код]
При одновременном действии на алканы оксидом серы (IV) и кислородом, при ультрафиолетовом облучении или при участии веществ, являющихся донорами свободных радикалов (диазометан, органические перекиси), протекает реакция сульфирования с образованием алкилсульфокислот:
- Ch4-Ch3-Ch3-Ch4→O2;SO2;hνCh4-Ch3-Ch3-Ch3-SO2OH{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{3}{\xrightarrow {O_{2};SO_{2};h\nu }}CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}SO_{2}OH}}}
Сульфохлорирование (реакция Рида)[править | править код]
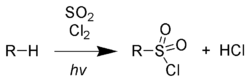 При облучении ультрафиолетовым излучением алканы реагируют со смесью SO2 и Cl2, После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.
При облучении ультрафиолетовым излучением алканы реагируют со смесью SO2 и Cl2, После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.
Развитие цепного процесса:
- RH+Cl⋅→R⋅+HCl{\displaystyle {\mathsf {RH+Cl\cdot \rightarrow R\cdot +HCl}}}
- R⋅+SO2→RSO2⋅{\displaystyle {\mathsf {R\cdot +SO_{2}\rightarrow RSO_{2}\cdot }}}
- RSO2⋅+Cl2→RSO2Cl+Cl⋅{\displaystyle {\mathsf {RSO_{2}\cdot +Cl_{2}\rightarrow RSO_{2}Cl+Cl\cdot }}}
Легче всего сульфохлорируются углеводы линейного строения, в отличие от реакций хлорирования и нитрования.[9]
Образовавшиеся сульфонилхлориды широко применяются в производстве ПАВ.
Нитрование[править | править код]
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных:
- RH+HNO3→RNO2+h3O{\displaystyle {\mathsf {RH+HNO_{3}\rightarrow RNO_{2}+H_{2}O}}}
Имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Реакции окисления[править | править код]
- Автоокисление
Окисление алканов в жидкой фазе протекает по свободно-радикальному механизму и приводит к образованию гидропероксидов, продуктов их разложения и взаимодействия с исходным алканом. Схема основной реакции автоокисления:
- RH+O2→R⋅+HOO⋅{\displaystyle {\mathsf {RH+O_{2}\rightarrow R\cdot +HOO\cdot }}}
- R⋅+O2→ROO⋅{\displaystyle {\mathsf {R\cdot +O_{2}\rightarrow ROO\cdot }}}
- ROO⋅+RH→ROOH+R⋅{\displaystyle {\mathsf {ROO\cdot +RH\rightarrow ROOH+R\cdot }}}
- Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
- Ch5+2O2→CO2+2h3O+ΔQ{\displaystyle {\mathsf {CH_{4}+2O_{2}\rightarrow CO_{2}+2H_{2}O+\Delta Q}}}
Значение Q достигает 46 000 — 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается оксид углерода(II) или уголь (в зависимости от концентрации кислорода).
- Каталитическое окисление
В реакциях каталитического окисления алканов могут образовываться спирты, альдегиды, карбоновые кислоты.
При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C могут образоваться:
Окисление также может осуществляться воздухом. Процесс проводится в жидкой или газообразной фазе. В промышленности так получают высшие жирные спирты и соответствующие кислоты.
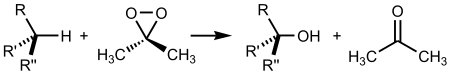
Реакция окисления алканов диметилдиоксираном:
Механизм реакций получения кислот путём каталитического окисления и расщепления алканов показан ниже на примере получения из бутана уксусной кислоты:
Термические превращения алканов[править | править код]
- Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
- Ch5→ot>1000oCC+2h3{\displaystyle {\mathsf {CH_{4}{\xrightarrow[{}]{^{o}t>1000^{o}C}}C+2H_{2}}}}
- C2H6→2C+3h3{\displaystyle {\mathsf {C_{2}H_{6}\rightarrow 2C+3H_{2}}}}
- Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
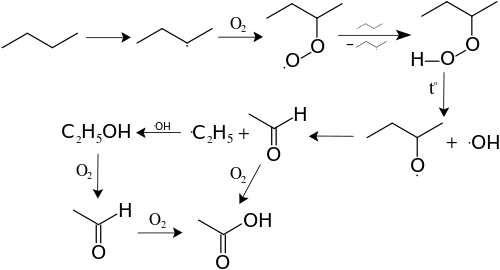
В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10—15 атомов углерода в углеродном скелете) и фракции солярового масла (12—20 атомов углерода). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана:
- 2Ch5→ot>1500oCC2h3+3h3{\displaystyle {\mathsf {2CH_{4}{\xrightarrow[{}]{^{o}t>1500^{o}C}}C_{2}H_{2}+3H_{2}}}}
Во время крекинга одна из связей (С-С) разрывается, образуя два радикала. Далее одновременно происходят три процесса, вследствие которых реакция дает множество различных продуктов.
- Ch4-Ch3:Ch4→1500∘CCh4-Ch3·+·Ch4{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{:}}CH_{3}{\xrightarrow {1500^{\circ }C}}CH_{3}{\text{-}}CH_{2}{\text{·}}+{\text{·}}CH_{3}}}}
1) Рекомбинация
- Ch4-Ch3·+·Ch3-Ch4→Ch4-Ch3-Ch3-Ch4{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{·}}+{\text{·}}CH_{2}{\text{-}}CH_{3}\rightarrow CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{3}}}}
- Ch4·+·Ch3-Ch4→Ch4-Ch3-Ch4{\displaystyle {\mathsf {CH_{3}{\text{·}}+{\text{·}}CH_{2}{\text{-}}CH_{3}\rightarrow CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{3}}}}
- Ch4·+·Ch4→Ch4-Ch4{\displaystyle {\mathsf {CH_{3}{\text{·}}+{\text{·}}CH_{3}\rightarrow CH_{3}{\text{-}}CH_{3}}}}
2) Диспропорционирование
- Ch4·+·Ch3-Ch4→Ch5+Ch3=Ch3{\displaystyle {\mathsf {CH_{3}{\text{·}}+{\text{·}}CH_{2}{\text{-}}CH_{3}\rightarrow CH_{4}+CH_{2}{\text{=}}CH_{2}}}}
- Ch4-Ch3·+·Ch3-Ch4→Ch4-Ch4+Ch3
октан — это… Что такое октан?
ОКТАН — (Octant) морской угломерный инструмент, подобный секстану, но меньших размеров. Применяется обычно в тех случаях, когда наблюдения не могут претендовать на большую точность. О. также пользуются при гидрографических работах. Самойлов К. И. Морской … Морской словарь
ОКТАН — Ch4(Ch3)6Ch4, бесцветная жидкость, tкип125,7 .С. Содержится в нефти и в больших количествах в синтетическом жидком топливе. Имеет низкую детонационную стойкость (октановое число 17 19) … Большой Энциклопедический словарь
октан — сущ., кол во синонимов: 4 • алкан (37) • газ (55) • парафин (14) • … Словарь синонимов
октан — а, м. octant m. <, лат. octans (octantis. 1. геом. Любая из восьми областей (углов), на которые пространство делится тремя взаимно перпендикулярными плоскостями. СИС 1954. 2. Астрономический прибор, применявшийся ранее для измерения угловых… … Исторический словарь галлицизмов русского языка
октан — октановый — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность Синонимы октановый EN octane … Справочник технического переводчика
Октан — У этого термина существуют и другие значения, см. Октан (значения). Октан … Википедия
октан — (гр. okto восемь) органическое соединение, насыщенный углеводород алифатического ряда; бесцветная жидкость; содержится в нефти, бензинах, откуда его выделяют ректификацией, нек рые изомеры октана, напр, изооктан, являются ценными компонентами… … Словарь иностранных слов русского языка
Октан — н октан, насыщенный углеводород (См. Насыщенные углеводороды) C8h28; бесцветная жидкость со специфическим запахом; tпл 56,8 °С, tkип 125,67 °С, плотность 0,7025 г/см3 (20 °С), октановое число 17 19; вместе с Изооктаном и др. изомерами… … Большая советская энциклопедия
октан — СН3(СН2)6СН3, бесцветная жидкость, tкип 125,7°C. Содержится в нефти и в больших количествах в синтетическом жидком топливе. Имеет низкую детонационную стойкость (октановое число 17 19). * * * ОКТАН ОКТАН, Ch4(Ch3)6Ch4, бесцветная жидкость,… … Энциклопедический словарь
Октан — ► octane Жидкий углеводород С8Н18 метанового ряда. Состав: 84.2% С, 15.8% Н. Существует восемнадцать структурных изомеров октана. Нормальный октан имеет температуру кипения +125,6°С, плотность 0,703. В нефти доказано присутствие пяти изомеров… … Нефтегазовая микроэнциклопедия
октан — Сигез углерод атомы булган углеводород, С8Н18; бензин составында була. ОКТАН САНЫ – Ягулыкның яну (шартлау) тизлеген күрсәтә торган зурлык … Татар теленең аңлатмалы сүзлеге
октан — это… Что такое октан?
ОКТАН — (Octant) морской угломерный инструмент, подобный секстану, но меньших размеров. Применяется обычно в тех случаях, когда наблюдения не могут претендовать на большую точность. О. также пользуются при гидрографических работах. Самойлов К. И. Морской … Морской словарь
ОКТАН — Ch4(Ch3)6Ch4, бесцветная жидкость, tкип125,7 .С. Содержится в нефти и в больших количествах в синтетическом жидком топливе. Имеет низкую детонационную стойкость (октановое число 17 19) … Большой Энциклопедический словарь
октан — сущ., кол во синонимов: 4 • алкан (37) • газ (55) • парафин (14) • … Словарь синонимов
октан — а, м. octant m. <, лат. octans (octantis. 1. геом. Любая из восьми областей (углов), на которые пространство делится тремя взаимно перпендикулярными плоскостями. СИС 1954. 2. Астрономический прибор, применявшийся ранее для измерения угловых… … Исторический словарь галлицизмов русского языка
октан — октановый — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность Синонимы октановый EN octane … Справочник технического переводчика
Октан — У этого термина существуют и другие значения, см. Октан (значения). Октан … Википедия
октан — (гр. okto восемь) органическое соединение, насыщенный углеводород алифатического ряда; бесцветная жидкость; содержится в нефти, бензинах, откуда его выделяют ректификацией, нек рые изомеры октана, напр, изооктан, являются ценными компонентами… … Словарь иностранных слов русского языка
Октан — н октан, насыщенный углеводород (См. Насыщенные углеводороды) C8h28; бесцветная жидкость со специфическим запахом; tпл 56,8 °С, tkип 125,67 °С, плотность 0,7025 г/см3 (20 °С), октановое число 17 19; вместе с Изооктаном и др. изомерами… … Большая советская энциклопедия
октан — СН3(СН2)6СН3, бесцветная жидкость, tкип 125,7°C. Содержится в нефти и в больших количествах в синтетическом жидком топливе. Имеет низкую детонационную стойкость (октановое число 17 19). * * * ОКТАН ОКТАН, Ch4(Ch3)6Ch4, бесцветная жидкость,… … Энциклопедический словарь
Октан — ► octane Жидкий углеводород С8Н18 метанового ряда. Состав: 84.2% С, 15.8% Н. Существует восемнадцать структурных изомеров октана. Нормальный октан имеет температуру кипения +125,6°С, плотность 0,703. В нефти доказано присутствие пяти изомеров… … Нефтегазовая микроэнциклопедия
октан — Сигез углерод атомы булган углеводород, С8Н18; бензин составында була. ОКТАН САНЫ – Ягулыкның яну (шартлау) тизлеген күрсәтә торган зурлык … Татар теленең аңлатмалы сүзлеге
октан — это… Что такое октан?
ОКТАН — (Octant) морской угломерный инструмент, подобный секстану, но меньших размеров. Применяется обычно в тех случаях, когда наблюдения не могут претендовать на большую точность. О. также пользуются при гидрографических работах. Самойлов К. И. Морской … Морской словарь
ОКТАН — Ch4(Ch3)6Ch4, бесцветная жидкость, tкип125,7 .С. Содержится в нефти и в больших количествах в синтетическом жидком топливе. Имеет низкую детонационную стойкость (октановое число 17 19) … Большой Энциклопедический словарь
октан — сущ., кол во синонимов: 4 • алкан (37) • газ (55) • парафин (14) • … Словарь синонимов
октан — а, м. octant m. <, лат. octans (octantis. 1. геом. Любая из восьми областей (углов), на которые пространство делится тремя взаимно перпендикулярными плоскостями. СИС 1954. 2. Астрономический прибор, применявшийся ранее для измерения угловых… … Исторический словарь галлицизмов русского языка
октан — октановый — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность Синонимы октановый EN octane … Справочник технического переводчика
Октан — У этого термина существуют и другие значения, см. Октан (значения). Октан … Википедия
октан — (гр. okto восемь) органическое соединение, насыщенный углеводород алифатического ряда; бесцветная жидкость; содержится в нефти, бензинах, откуда его выделяют ректификацией, нек рые изомеры октана, напр, изооктан, являются ценными компонентами… … Словарь иностранных слов русского языка
Октан — н октан, насыщенный углеводород (См. Насыщенные углеводороды) C8h28; бесцветная жидкость со специфическим запахом; tпл 56,8 °С, tkип 125,67 °С, плотность 0,7025 г/см3 (20 °С), октановое число 17 19; вместе с Изооктаном и др. изомерами… … Большая советская энциклопедия
октан — СН3(СН2)6СН3, бесцветная жидкость, tкип 125,7°C. Содержится в нефти и в больших количествах в синтетическом жидком топливе. Имеет низкую детонационную стойкость (октановое число 17 19). * * * ОКТАН ОКТАН, Ch4(Ch3)6Ch4, бесцветная жидкость,… … Энциклопедический словарь
Октан — ► octane Жидкий углеводород С8Н18 метанового ряда. Состав: 84.2% С, 15.8% Н. Существует восемнадцать структурных изомеров октана. Нормальный октан имеет температуру кипения +125,6°С, плотность 0,703. В нефти доказано присутствие пяти изомеров… … Нефтегазовая микроэнциклопедия
октан — Сигез углерод атомы булган углеводород, С8Н18; бензин составында була. ОКТАН САНЫ – Ягулыкның яну (шартлау) тизлеген күрсәтә торган зурлык … Татар теленең аңлатмалы сүзлеге