Определение аккумулятор – расшифровка обозначений, а также как узнать год выпуска и дату производства АКБ, где находятся надписи
- 11.06.2020
Что такое аккумулятор?
Аккумулятор — химический источник тока, в котором энергия химической реакции многократно преобразуется в электрическую и наоборот. Таким образом, аккумулятор, имея возможность преобразовывать химическую энергию в электрическую, способен запасать ее и хранить в течение длительного времени. Заряжаясь, аккумулятор накапливает электрическую энергию, разряжаясь, отдает ее потребителю.
Первый аккумулятор (прототип современного свинцово-кислотного) был создан в 1860 г. Гастоном Планте и представлял собой две свинцовые полосы, разделенные пористым изолятором и помещенные в раствор серной кислоты. Выполненный по такой схеме единичный аккумуляторный элемент способен обеспечивать напряжение на выходе около 2 вольт. Емкость такого аккумулятора была невелика, и рабочие характеристики достигались только после многократных зарядно-разрядных циклов. Аккумулятор, аналогичный по своей конструкции современному, был создан в 1881 г. Пластины в нем представляли собой пакеты свинцовых решеток с запрессованной в них активной массой — пастой двуокиси свинца. Точно также и в современном свинцово-кислотном аккумуляторе активными веществами являются свинец и двуокись свинца, а электролитом — водный раствор серной кислоты.
Положительно заряженная пластина (электрод) представляет собой свинцовую решетку
с активной массой из двуокиси свинца (PbO2), а электрод со знаком минус
— решетку с активной массой из губчатого свинца (Pb). Во избежание возникновения
короткого замыкания между пластинами, их разделяют пористыми сепараторами из изоляционного
материала. Собранные блоки помещаются в корпус и заливаются электролитом (раствором
серной кислоты плотностью 1.27-1.29 г/см
Если к аккумулятору подключить нагрузку, то свинцовые пластины с активной массой, электролит и нагрузка образуют замкнутую цепь. Внутри аккумулятора начинается химическая реакция, в результате которой активная масса обоих электродов начнет менять первоначальный состав, преобразуясь из губчатого свинца и его двуокиси в сернокислый свинец (сульфат свинца PbSO4), а плотность электролита начинает падать. В итоге, в цепи образуется направленное движение ионов, и течет электрический ток. Такой процесс представляет собой разряд аккумулятора. При подключении к аккумулятору внешнего источника тока начинается обратный процесс — заряд. При заряде активная масса пластин восстанавливает свой первоначальный состав, плотность электролита растет. Эти химические процессы можно описать следующими уравнениями:
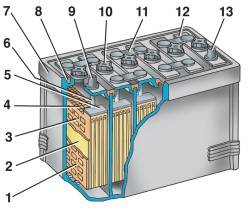 |
1 – отpицательная пластина; 2 – сепаpатоp; 3 – положительная пластина; 4 – пpедохpанительная сетка; 5 – баpетка; 6 – штыpь; 7 – моноблок; 8 – уплотнительная мастика; 9 – положительный вывод; 11 – межэлементная пеpемычка; 12 – кpышка; 13 – отpицательный вывод |
— на положительной пластине: PbO2 + H2SO4 = PbSO4+ H2O + 2e — на отрицательной пластине: Pb + H2SO4 = PbSO4+ H2 — 2e |
Батареи первого поколения — батареи с жидким электролитом
Активной массой положительного электрода обычной батареи служит двуокись свинца, отрицательного — чистый свинец, а электролитом — водный раствор серной кислоты. При разряде батареи активные массы пластин вступают в химическую реакцию с электролитом, вырабатывая электрический ток. При этом они преобразуются в сульфат свинца, а в электролит выделяется вода. При заряде происходит обратный процесс.
Для повышения твердости и коррозионной стойкости электродов свинцовые решетки, удерживающие активную массу, сначала легировали добавками сурьмы и мышьяка. Но сурьма способствует повышенному расходу воды и снижению ЭДС аккумуляторной батареи в процессе эксплуатации. Такое неудобство, как необходимость обслуживания классических батарей, заставила производителей искать способы упрощения эксплуатации. Сначала было снижено содержание сурьмы в пластинах, затем из отрицательных пластин сурьму вытеснил кальций. Гибридные АКБ продолжали требовать долива воды, но уже гораздо реже. Применение кальция в положительных пластинах привело к появлению батарей, теоретически не требующих долива на протяжении всего срока эксплуатации. Однако, кальциевые батареи имеют другой недостаток: они плохо переносят глубокие разряды. Чтобы повысить устойчивость АКБ к глубоким разрядам, в свинцово-кальциевый сплав положительных пластин стали добавлять серебро (Ag). Так возникли самые распространенные на сегодняшний день необслуживаемые АКБ.
Батареи второго поколения — герметизированные гелевые батареи (Gelled Electrolite)
В таких батареях кислотный электролит находится в гелеобразном состоянии благодаря добавлению в него соединений кремния. Гелевый электролит позволяет добиться полной герметичности батареи, так как все газовыделение происходит внутри сильно развитой системы пор в массе геля. Это решает проблему необслуживаемости АКБ.
Однако аккумуляторы с загущенным электролитом имеют несколько худшие нагрузочные характеристики по сравнению с классическими АКБ: большие токи с них снять сложнее из-за более высокого внутреннего сопротивления. Батареи с жидким электролитом лучше работают при высоких токах нагрузки при коротких режимах. Кроме того, гелевые батареи критичны к температуре окружающей среды и стабильности зарядного напряжения. Для их подзаряда нужно использовать зарядные устройства, обеспечивающие нестабильность напряжения заряда не хуже +/- 1% для предотвращения обильного газовыделения.
Батареи типа GEL наиболее устойчивы к глубоким разрядам и не нуждаются в обслуживании в течение всего срока службы при нормальных условиях эксплуатации. Но при их нарушении происходит быстрое старение батареи.
Батареи третьего поколения — герметизированные батареи с абсорбированным сепараторами электролитом AGM (Absorptive Glass Mat)
AGM-технология вновь вернулась к жидкой кислоте, но теперь электролит удерживается в порах сепаратора из ультратонких стеклянных волокон, размещенных между электродами. Такой сепаратор представляет собой пористую систему, в которой каппилярные силы удерживают электролит. При этом количество электролита дозируется так, чтобы мелкие поры были заполнены, а крупные оставались свободными для свободной циркуляции газов. Принцип рециркуляции такой же, как у гелевых АКБ: блуждая по порам сепаратора, газы успевают «вернуться» в электролит, не покидая корпус аккумулятора. Таким образом, AGM батареи также не требуют обслуживания в течение всего срока эксплуатации.
Конструкция AGM батарей позволяет не только герметизировать корпус, но и сохранить работоспособность батареи даже в случае повреждений наружной оболочки. Они нечувствительны к колебаниям температуры, долговечны и виброустойчивы.
Но главное преимущество таких батарей — в стойкости к глубоким разрядам. Происходит это за счет повышенной плотности сборки блока пластин и удержания активной массы. Электролит «связан», и разряд аккумулятора не сопровождается его выпариванием с последующим окислением пластин, как это случается с традиционными АКБ.
Но, как и гелевые, AGM батареи чувствительны к превышению зарядного напряжения, только причиной здесь является существенно меньшее количество электролита в них. Поэтому единственным условием для длительной эксплуатации такого рода аккумуляторов является правильный выбор зарядного устройства.
Версия для печатиАККУМУЛЯТОР — это… Что такое АККУМУЛЯТОР?
АККУМУЛЯТОР — (от лат. accumulare скоплять). Изобретенный В. Армстронгом прибор для накопления электрической энергии. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. АККУМУЛЯТОР Прибор для накопления механической энергии.… … Словарь иностранных слов русского языка
АККУМУЛЯТОР — (от лат. accumulator собиратель) устройство для накопления энергии с целью ее последующего использования. 1) Электрический аккумулятор преобразует электрическую энергию в химическую и по мере надобности обеспечивает обратное преобразование;… … Большой Энциклопедический словарь
аккумулятор — а м. accumulateur, нем. Akkumulator, лат. < accumulator. 1564. Лексис. 1. Стрелецкое войско было единственным социальным фактором способным сыграть роль аккумулятора народных жалоб. Милюков Национализм. // 3 3 178. Аккумулятор и одновременно… … Исторический словарь галлицизмов русского языка
АККУМУЛЯТОР — (от латинского accumulator собиратель), устройство для накопления энергии с целью ее последующего использования. 1) Электрический аккумулятор гальванический элемент многоразового использования; преобразует электрическую энергию в химическую и… … Современная энциклопедия
Аккумулятор — (от латинского accumulator собиратель), устройство для накопления энергии с целью ее последующего использования. 1) Электрический аккумулятор гальванический элемент многоразового использования; преобразует электрическую энергию в химическую и… … Иллюстрированный энциклопедический словарь
АККУМУЛЯТОР — АККУМУЛЯТОР, аккумулятора, муж. (лат. accumulator собиратель). 1. Прибор, заряженный электричеством и служащий источником электрического тока (физ.). 2. Вообще прибор для накопления энергии (тех.). Гидравлический аккумулятор. Паровой аккумулятор … Толковый словарь Ушакова
АККУМУЛЯТОР — (вторичный элемент или накопительная батарея), гальванический элемент, или батарея, которую можно многократно подзаряжать. Широко известный автомобильный аккумулятор представляет собою свинцово кислотный элемент … Научно-технический энциклопедический словарь
аккумулятор — источник, накопитель Словарь русских синонимов. аккумулятор сущ., кол во синонимов: 8 • автоаккумулятор (1) • … Словарь синонимов
аккумулятор — Гальванический элемент, предназначенный для многократного разряда за счет восстановления емкости путем заряда электрическим током. [ГОСТ 15596 82] аккумулятор элемент Совокупность электродов и электролита, образующая основу устройства… … Справочник технического переводчика
Аккумуляторная батарея — это… Что такое Аккумуляторная батарея?
- Аккумуляторная батарея
- электрическая, группа однотипных Аккумуляторов, соединённых электрически и конструктивно для получения напряжения, силы тока, электрического заряда (распространён термин «ёмкость») или мощности, которых один элемент дать не может. При параллельном соединении аккумуляторов напряжение А. б. равно напряжению каждого из элементов, а общий электрический заряд — сумме электрических зарядов отдельных аккумуляторов. При последовательном соединении суммируется эдс. Смешанное соединение осуществляют для повышения напряжения и электрического заряда А. б. по сравнению с напряжением и электрическим зарядом отдельного аккумулятора. Служит источником постоянного тока.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
- Аккумулятор давления
- Аккумуляция
Смотреть что такое «Аккумуляторная батарея» в других словарях:
Аккумуляторная батарея — Аккумуляторная батарея батарея аккумуляторов, соединенных между собой в одном изделии. Аккумуляторная батарея служит источником постоянного тока. В обиходе часто встречается сокращение «АКБ» или просто «Аккумулятор». Аккумуляторная батарея … Википедия
аккумуляторная батарея — батарея Электрически соединенные между собой аккумуляторы, оснащенные выводами и заключенные, как правило, в одном корпусе. [ГОСТ 15596 82] аккумуляторная батарея батарея Два или более аккумуляторов, соединенных между собой и используемых в… … Справочник технического переводчика
АККУМУЛЯТОРНАЯ БАТАРЕЯ — группа однотипных электрических аккумуляторов, соединенных электрически и конструктивно для получения необходимых значений тока и напряжения … Большой Энциклопедический словарь
АККУМУЛЯТОРНАЯ БАТАРЕЯ — (Storage battery) ряд аккумуляторов, соединенных между собой последовательно или параллельно. Самойлов К. И. Морской словарь. М. Л.: Государственное Военно морское Издательство НКВМФ Союза ССР, 1941 … Морской словарь
аккумуляторная батарея — – ряд соединенных вместе аккумуляторов в едином корпусе. EdwART. Словарь автомобильного жаргона, 2009 … Автомобильный словарь
Аккумуляторная батарея — (secondary battery) два или более аккумуляторов (элементов), соединенных между собой и используемых в качестве источника электрической энергии… Источник: ИНСТРУКЦИЯ ПО ЭКСПЛУАТАЦИИ СТАЦИОНАРНЫХ СВИНЦОВО КИСЛОТНЫХ АККУМУЛЯТОРНЫХ БАТАРЕЙ В… … Официальная терминология
аккумуляторная батарея — 1.3.8. аккумуляторная батарея : Сборка из аккумуляторов, предназначенная для использования в качестве источника электрической энергии, характеризующаяся свойственными ей напряжением, размерами, расположением выводов, емкостью и другими данными.… … Словарь-справочник терминов нормативно-технической документации
аккумуляторная батарея — akumuliatorių baterija statusas T sritis chemija apibrėžtis Nuosekliai arba lygiagrečiai sujungtų akumuliatorių grupė. atitikmenys: angl. accumulator battery; secondary battery; storage battery rus. аккумуляторная батарея; вторичная батарея … Chemijos terminų aiškinamasis žodynas
аккумуляторная батарея — группа однотипных электрических аккумуляторов, соединённых электрически и конструктивно для получения необходимых значений тока и напряжения. * * * АККУМУЛЯТОРНАЯ БАТАРЕЯ АККУМУЛЯТОРНАЯ БАТАРЕЯ, группа однотипных электрических аккумуляторов,… … Энциклопедический словарь
аккумуляторная батарея — akumuliatorių baterija statusas T sritis automatika atitikmenys: angl. accumulator battery; storage battery vok. Akkumulatorbatterie, f; Akkumulatorenbatterie, f rus. аккумуляторная батарея, f pranc. batterie d accumulateurs, f … Automatikos terminų žodynas
аккумуляторная батарея — akumuliatorių baterija statusas T sritis fizika atitikmenys: angl. accumulator battery vok. Akkumulatorenbatterie, f rus. аккумуляторная батарея, f pranc. batterie d’accumulateurs, f … Fizikos terminų žodynas
Химический источник тока — Википедия
Хими́ческий исто́чник то́ка (аббр. ХИТ) — источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию.
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был «элемент Вольта» — сосуд с серной кислотой с опущенными в него цинковой и медной пластинками, с проволочными токовыводами. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа «вольтовым столбом». Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Даниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниеля».
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор, поместив скрученную в рулон тонкую свинцовую пластину в серную кислоту. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 в качестве деполяризатора с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-Йорке Конрад Хьюберт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Самый старый, поныне работающий гальванический элемент — серебряно-цинковая батарея, изготовленная в Лондоне в 1840 году. Подключенный к двум таким последовательно соединенным батареям звонок работает и по сей день в Кларендонской лаборатории Оксфорда[1].
Основу химических источников тока составляют два электрода (положительно заряженный анод, содержащий восстановитель, и отрицательно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода (отрицательного полюса химического источника тока) к положительному. Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
По возможности или невозможности повторного использования химические источники тока делятся на:
- гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций невозможно перезарядить;
- электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
- топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно, пока обеспечивается подача реагентов.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент, цинк-хлорный аккумулятор).
Некоторые виды химических источников тока[править | править код]
Гальванические элементы[править | править код]
Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
- См. также Категория: Гальванические элементы.
| Тип | Катод | Электролит | Анод | Напряжение, В |
|---|---|---|---|---|
| Литий-железо-дисульфидный элемент | FeS2 | Li | 1,50 | |
| Марганцево-цинковый элемент | MnO2 | KOH | Zn | 1,56 |
| Марганцево-оловянный элемент | MnO2 | KOH | Sn | 1,65 |
| Марганцево-магниевый элемент | MnO2 | MgBr2 | Mg | 2,00 |
| Свинцово-цинковый элемент | PbO2 | H2SO4 | Zn | 2,55 |
| Свинцово-кадмиевый элемент | PbO2 | H2SO4 | Cd | 2,42 |
| Свинцово-хлорный элемент | PbO2 | HClO4 | Pb | 1,92 |
| Ртутно-цинковый элемент | HgO | KOH | Zn | 1,36 |
| Ртутно-кадмиевый элемент | HgO2 | KOH | Cd | 1,92 |
| Окисно-ртутно-оловянный элемент | HgO2 | KOH | Sn | 1,30 |
| Хром-цинковый элемент | K2Cr2O7 | H2SO4 | Zn | 1,8—1,9 |
Другие типы:
Электрические аккумуляторы[править | править код]
Электрический аккумулятор — химический источник тока многоразового действия (то есть в отличие от гальванического элемента химические реакции, непосредственно превращаемые в электрическую энергию, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
- См. также Категория: Аккумуляторы.
Топливные элементы[править | править код]
Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.
- См. также Категория: Топливные элементы.
- ↑ Exhibit 1 — The Clarendon Dry Pile». Oxford Physics Teaching, History Archive. Retrieved 18 January 2008
- ↑ В демонстрационных экспериментах зачастую используют мякоть плодов апельсина, яблоки и пр.
- Дасоян М. А. Химические источники тока. — 2-е изд. — Л., 1969.
- Романов В. В., Хашев Ю. М. Химические источники тока. — М., 1968.
- Орлов В. А. Малогабаритные источники тока. — 2-е изд. — М., 1970.
- Вайнел Д. В. Аккумуляторные батареи. — пер. с англ., 4-е изд. — М. — Л., 1960.
- The Primary Battery / ed. G. W. Heise, N. C. Cahoon. — N. Y. — L., 1971. — Т. v. 1.
| |||
Автомобильный аккумулятор: основные термины и определения
18.01.2017
Аккумулятор
Аккумулятор – дословно это накопитель. Способен накапливать энергию и отдавать ее в какое либо другое время.
Активная масса
Это составляющая часть электродов, которая претерпевает химические преобразования при прохождении электрического тока.
Ампер (A):
Это единица силы тока.
Ампер,час (А*ч)
Это мера электрической энергии, равная произведению силы тока в амперах на время в часах.
Баретки
Это токопроводящие элементы, соединяющие одноименные электроды одной ячейки.
Батарея
В данном случае подразумевается аккумуляторная батарея (АКБ).
Блок электродов в сборе
Это блок, состоящий из положительных и отрицательных электродов, а также сепараторов, входящих в комплект одной ячейки.
Вода
В данном пособии под этим понятием подразумевается только дистиллированная вода.
Вода для доливки
Эта вода, которая используется для возмещения потерь электролита в результате электролитического разложения воды или испарения. Такая вода должна соответствовать нормативу VDE 0510 в отношении содержания примесей. Доливать в батарею можно только дистиллированную воду! Ни в коем случае нельзя применять водопроводную воду.
Вольт (В)
Это мера напряжения.
Выпрямитель
Выпрямитель позволяет преобразовывать переменный ток в постоянный.
Газообразование
Речь идет об образовании газов на электродах свинцового аккумулятора. Особенно обильно выделяется гремучий газ в конечной фазе заряда свинцового аккумулятора. Этот газ образуется в результате разложения содержащейся в электролите воды на водород и кислород.
Генератор
Так называют электродинамический источник тока, который приводится от вала автомобильного двигателя и служит для заряда аккумуляторной батареи и питания потребителей, подключенных к бортовой сети. Обычно применяются генераторы переменного тока с выпрямителями.
Глубокий разряд
Это отбор тока, который приводит к полному разряду батареи. Батарея считается полностью разряженной, если плотность электролита не превышает 1,14 г/см3, а ЭДС ниже 11,9 В.
Гремучий газ
Это взрывоопасная смесь водорода и кислорода.
Денсиметр (Ареометр)
Это прибор, состоящий из стеклянной трубки, поплавка и резиновой груши. На поплавок нанесены штрихи для определения плотности электролита.
Дистиллированная вода
Дистиллированная вода доливается в батарею для возмещения ее потерь в результате газообразования, а также вследствие испарения. Она должна соответствовать определенным требованиям к чистоте от примесей (см. норматив VDE 0510). Для доливки аккумуляторных батарей следует использовать исключительно дистиллированную воду!
Диффузия
Под химической диффузией понимают неупорядоченное движение частиц жидкостей или газов, которое приводит к выравниванию их концентраций во всем занимаемом объеме.
Емкость батареи
Это величина электрической энергии, которую может отдать аккумуляторная батарея. Она измеряется в ампер-часах (А*ч).
Заряд
Это процесс преобразования электрической энергии в химическую при протекании тока через батарею в соответствующем направлении.
Зарядный ток
Это ток, при котором заряжается батарея. Ограничивать 10% от номинальной емкости аккумулятора.
Конечное напряжение
Это установленное нормативами значение напряжение, до которого допускается его снижение при разряде батареи током определенной величины. При достижении конечного напряжения процесс разряда считается законченным. Для автомобильных АКБ оно равно 12,0 Вольт.
Коэффициент преобразования энергии
Это отношение электрической энергии, затраченной при полном заряде батареи, к энергии, которая ранее была ею отдана.
Метки для определения уровня электролита
Эти метки позволяют определить положение уровня относительно допустимых значений.
Моноблок
Это корпус батареи, разделенный перегородками на отдельные ячейки.
Напряжение заряда
Это напряжение, под которым производится заряд батареи. До 14,4 Вольт
Напряжение на клеммах
Это напряжение между полюсными выводами батареи.
Напряжение перезаряда
Это напряжение, при превышении которого резко увеличивается газообразование. Любое напряжение выше 14,4 Вольт!
Номинальные значения
Это установленные стандартами DIN 40729 и DIN 72311 значения напряжения, емкости, плотности, температуры и т. п. Например: номинальное напряжение аккумуляторной батареи это произведение номинального напряжения свинцового аккумулятора (2,1 В) на число последовательно включенных аккумуляторов или ячеек (например, 6 ячеек у 12 вольтовой батареи).
Номинальная емкость
Это количество электрической энергии, которую может отдать батарея в режиме 20 часового разряда током равным I=емкость/20. Разряд ведется до напряжения 10,8 Вольт.
Крышка аккумулятора
Эта крышка закрывает все ячейки батареи. Она соединяется с моноблоком посредством контактно-тепловой сварки.
Отвод газов / Вентиляция батареи
У стартерных батарей образующиеся при их эксплуатации газы обычно отводятся через пластиковую трубку в безопасное место.
Отрицательный электрод
Это электрод, активная масса которого у заряженной батареи состоит из губчатого свинца.
Полюсные клеммы (терминалы)
Это наконечники соединительных кабелей, которые закрепляются на них посредством пайки или винтов.
Плотность электролита
Это характеристика физического тела, равная отношению его массы к занимаемому объему. Она измеряется в кг/л или в г/см3.
Полный заряд
Это заряд батареи, при достижении которого прекращается процесс химического преобразования энергии. Свинцовая батарея считается полностью заряженной, если в последней фазе ее заряда плотность электролита и напряжение на выводах стабилизировались и НРЦ батареи достигло напряжения 13,8 Вольт.
Положительный электрод
Это электрод, активная масса которого у заряженной батареи состоит из двуокиси свинца (PbO2).
Полюсные выводы
Полюсные выводы служат для подвода зарядного тока и для его отдачи под общим напряжением батареи.
Последовательное соединение
При последовательном соединении (например, два АКБ в грузовике или автобусе) соединяются разноименные выводы соседних акб.
Пробка центральной вентиляции
У батарей с центральной системой вентиляции эта пробка служит для перекрытия газоотводного отверстия в крышке батареи. У батарей с жидким электролитом этой пробкой закрывается газоотводное отверстие только с одной стороны батареи. Эту пробку не следует путать с пробкой ячейки.
Пробки ячеек
Эти пробки закрывают отверстия ячеек в крышке батареи.
Пусковая мощность
Это мощность, которая требуется для пуска двигателя.
Разряд батареи
Это переход химической энергии в электрическую.
Решетка электрода
Решетка электрода служит для удерживания активной массы, а также для подвода и отвода тока к ней. Применяются свинцовые решетки.
Саморазряд
Это разряд батареи в результате протекания определенных химических процессов в ней, без отдачи тока каким-либо потребителям.
Свинцовая батарея
Это батарея с свинцовыми решетками электродов, причем у заряженной батареи активная масса положительных электродов состоит из двуокиси свинца, а активная масса отрицательных электродов – из губчатого свинца. В качестве электролита такой батареи служит водный раствор серной кислоты.
Сепаратор
Это установленный между разноименными электродами разделитель, который пропускает ионы. В батареях с жидким электролитом обычно применяются сепараторы из полиэтилена, а батареи типа AGM оснащаются сепараторами из нетканных материалов.
Серная кислота (h3SO4)
Эта кислота используется для получения электролита путем ее разбавления водой.
Срок службы батареи
Это время эксплуатации батареи до ее перехода в негодное состояние. Обычно это 3-4 года
Стартерная батарея
Все автомобильные аккумуляторы стартерные. От тяговых их отличает большее количество электродов, которые при пуске мотора представляют собой обычный плоский конденсатор. Отсюда и мощные пусковые токи. Автомобильные аккумуляторы используется для пуска двигателя и питания его системы зажигания.
Степень заряженности
Это величина, которая характеризует использование емкости батареи. 12,7В напряжение полностью заряженной АКБ (11,9В это 0% заряда)
Сульфатация
Это процесс превращения активной массы свинцовой батареи в крупнокристаллический сульфат свинца. И более «опасный» для АКБ сульфат кальция.
Ток холодной прокрутки по стандартам EN и DIN
Это заявленный производителем разрядный ток, по величине которого судят о способности батареи обеспечивать пуск двигателя при низких температурах. Токи холодной прокрутки по стандартам EN и DIN – это различные по величине токи, которые прежде всего служат для определения пусковых качеств батарей при низких температурах, но при отличающихся условиях их испытаний, которые приведены в новом стандарте EN или в старом стандарте DIN. Поэтому на корпус батареи наносятся два значения тока холодной прокрутки. Например, для батареи емкостью 60 А·ч может быть указан ток силой 480 А по стандарту EN и 280 А по стандарту DIN. Этот ток батарея должна отдавать при температуре –18°C в течение различных промежутков времени, так как конечное напряжение установлено этими стандартами на различных уровнях. Например, в соответствии со стандартом EN батарея емкостью 60 А·ч должна отдавать ток силой 480 А при температуре –18°C в течение 10 секунд, причем напряжение не должно упасть ниже 7,5 В. Через 10 секунд выдержки батарея вновь нагружается, но током 280 А при той же температуре. Этот ток она должна отдавать в течение 133 секунд, причем напряжение не должно упасть ниже 6 В.
Уровень электролита
В данном случае подразумевается уровень жидкого электролита в ячейках батареи. Min. уровень — на 1см выше уровня электродов.
Ускоренный заряд батареи
Это заряд током, который значительно превосходит его обычные значения. При этом сокращается время заряда, но полная емкость батареи не используется. Внимание! Не следует применять режим ускоренного заряда батареи обычным ЗУ, так как он может привести к ее повреждению. Для ускоренного заряда применять только ЗУС Версия-4 ТОР
Уровень электролита
В данном случае речь идет об уровне жидкого электролита в аккумуляторе.
ЭДС батареи (НРЦ)
Это установившееся напряжение на полюсных выводах батареи при разомкнутой цепи, при полном отсутствии токов заряда или разряда
Электролит
Это жидкость, обладающей ионной проводимостью. Способна проводить электрический ток между погруженными в нее электродами . В качестве электролита используется, например, разбавленная водой серная кислота.
SAE
Это автомобильный стандарт США (Society of Automotive Engineers)
EN
Сокращение от «Europe Norm» (Европейский стандарт).
Как отличить батарейку от аккумуляторной батарейки
Иногда возникает необходимость понять, что перед вами – обычная батарейка или аккумуляторная перезаряжаемая. По внешнему виду, по цвету, размерам они почти идентичны и если не знать небольших нюансов, можно по незнанию выкинуть более дорогостоящую аккумуляторную в мусор или же воткнуть в зарядное устройство обычную батарейку и в лучшем случаем ничего не произойдет, а в худшем может и пожар возникнуть.
По внешнему виду
Если на проверяемых батарейках сохранилась этикетка, то узнать, что перед вами проще простого:
- Смотрим наличие надписи – rechargeable или – do not recharge. В первом случае это перезаряжаемые аккумуляторы, во втором — обычные батарейки, надпись гласит – не перезаряжайте. Иногда можно найти надпись – Alkaline, так маркируют обычные батарейки с повышенной емкостью.
- Наличие цифр и на конце надпись mAh – означает, что перед вами аккумулятор, а цифры это емкость. Для батареек емкость не указывается.
 Все признаки аккумуляторной батарейки.
Все признаки аккумуляторной батарейки. Обычная батарейка. Обратите внимание на надпись.
Обычная батарейка. Обратите внимание на надпись.
Обозначение на аккумуляторных батарейках: Ni-Cd – никель-кадмиевый, Ni-Mh – никель-металлогидридный, Li-Ion – литий-ионный аккумулятор.
Обычно этих отличительных признаков достаточно для определения типа батареи. Аккумуляторные батареи в несколько раз дороже обычных.
А что делать, если нет этикетки и каких либо надписей? Тут поможет мультиметр. Померьте напряжение батарейки: обычная батарейка покажет 1,6 V, аккумуляторная обычно не выше 1,2 V.

В продаже, все чаще, начали встречаться аккумуляторные батареи с повышенным напряжением – 1,6 V.
Отличия между типами аккумуляторных батарей
Ni-Cd – никель-кадмиевый: имеет выраженную память заряда, такие батареи желательно разряжать полностью, быстро разряжаются на холоде, самые дешевые.
Ni-Mh – никель-металлогидридный: чуть дороже, менее меньший эффект памяти и более емкие нежели у Ni-Cd, хорошо переносят минусовые температуры.
Li-Ion – литий-ионный аккумулятор: главный плюс – их можно заряжать в любое удобное время, эффекта памяти практически нет, самые дорогие из аккумуляторов.
Отличить литиевую батарейку от других типов аккумуляторной батареи можно по внешнему виду, маркировке. Обозначение на батарее Li-Ion соответствует литиевой батарее.

