Платина катализатор – Платиновый катализатор, способ его приготовления, способ его регенерации и способ получения сульфата гидроксиламина
- 16.03.2020
Платина — Википедия
| Платина | |
|---|---|
| ← Иридий | Золото → | |
 Кристаллы платины | |
| Название, символ, номер | Платина / Platinum (Pt), 78 |
| Атомная масса (молярная масса) | 195,084(9)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d9 6s1 |
| Радиус атома | 139 пм |
| Ковалентный радиус | 130 пм |
| Радиус иона | (+4e) 65 (+2e) 80 пм |
| Электроотрицательность | 2,28 (шкала Полинга) |
| Электродный потенциал | Pt←Pt2+ 1,20 В |
| Степени окисления | 4, 2, 0 |
| Энергия ионизации (первый электрон) | 868,1 (9,00) кДж/моль (эВ) |
| Плотность (при н. у.) | 21,09-21,45[2][3] г/см³ |
| Температура плавления | 2041,4 K (1768,3 °C, 3214,9 °F)[2] |
| Температура кипения | 4098 K (3825 °C, 6917 °F)[2] |
| Уд. теплота плавления | 21,76 кДж/моль |
| Уд. теплота испарения | ~470 кДж/моль |
| Молярная теплоёмкость | 25,85[3] Дж/(K·моль) |
| Молярный объём | 9,10 см³/моль |
| Структура решётки | кубическая гранецентрированная |
| Параметры решётки | 3,920 Å |
| Температура Дебая | 230,00 K |
| Теплопроводность | (300 K) 71,6 Вт/(м·К) |
| Тепловое расширение | (25 °C) 8,8 |
| Модуль Юнга | 168 ГПа |
| Модуль сдвига | 61 ГПа |
| Модуль объёмной упр. | 230 ГПа |
| Коэффициент Пуассона | 0,38 |
| Твёрдость Мооса | 3,5 |
| Твёрдость Виккерса | 549 МПа |
| Твёрдость Бринелля | 392 МПа |
| Номер CAS | 7440-06-4 |
| 78 | Платина |
| 4f145d96s1 | |
Пла́тина (Pt от лат. Platinum) — химический элемент 10-й группы (по устаревшей классификации — побочной подгруппы восьмой группы), 6-го периода периодической системы химических элементов, с атомным номером 78; блестящий благородный металл серебристо-белого цвета.
В Старом Свете платина не была известна до середины XVI века, однако цивилизации Анд (инки и чибча) добывали и использовали её с незапамятных времён. Первыми европейцами, познакомившимися с платиной в середине XVI века, были конкистадоры. Считается, что первым в литературе упомянул о платине Скалигер в опубликованной в 1557 году книге «Экзотерические упражнения в 15 книгах», где он, полемизируя с Кардано о понятии «металл», рассказал о некоем веществе из Гондураса, которое нельзя расплавить. Вероятно, этим веществом и была платина
В 1735 году испанский король издаёт указ, повелевающий платину впредь в Испанию не ввозить. При разработке россыпей в Колумбии повелевалось тщательно отделять её от золота и топить под надзором королевских чиновников в глубоких местах речки Рио-дель-Пинто (приток реки Сан-Хуан), которую стали именовать Платино-дель-Пинто. А ту платину, которая уже привезена в Испанию, повелевалось всенародно и торжественно утопить в море. Королевское распоряжение было отменено через 40 лет, когда мадридские власти приказали доставлять платину в Испанию, чтобы самим фальсифицировать золотые и серебряные монеты. В 1820 году в Европу было доставлено от 3 до 7 тонн платины. Здесь с нею познакомились алхимики, считавшие самым тяжёлым металлом золото. Необычайно плотная платина оказалась тяжелее золота, поэтому алхимики посчитали её непригодным металлом и наделили адскими чертами. Некоторое применение платина нашла позже во Франции, когда из неё был изготовлен эталон метра, а позже эталон килограмма
Согласно некоторым источникам, испанский математик и мореплаватель А. де Ульоа в 1744 году привёз образцы платины в Лондон
В России ещё в 1819 году в россыпном золоте, добытом на Урале, был обнаружен «новый сибирский металл», который сначала называли белым золотом. Платина встречалась на Верх-Исетских, а затем и на Невьянских и Билимбаевских приисках. Богатые россыпи платины были открыты во второй половине 1824 года, а на следующий год в России началась её добыча
Название платине было дано испанскими конкистадорами, которые в середине XVI в. впервые познакомились в Южной Америке (на территории современной Колумбии) с новым металлом, внешне похожим на серебро (исп. plata). Слово буквально означает «маленькое серебро», «серебришко». Объясняется такое пренебрежительное название исключительной тугоплавкостью платины, которая не поддавалась переплавке, долгое время не находила применения и ценилась вдвое ниже, чем серебро.
Месторождения[править | править код]

Платина является одним из самых редких металлов: её среднее содержание в земной коре (кларк) составляет 5⋅10−7 % по массе[3]. Даже так называемая самородная платина является сплавом, содержащим от 75 до 92 процентов платины, до 20 процентов железа, а также иридий, палладий, родий, осмий, реже медь и никель[7]:207.
Основная часть месторождений платины (более 90 %) заключена в недрах пяти стран. К этим странам относятся ЮАР (Бушвелдский комплекс), США, Россия, Зимбабве, Китай.
В России основными месторождениями металлов платиновой группы являются: Октябрьское, Талнахское и Норильск-1 сульфидно-медно-никелевые в Красноярском крае в районе Норильска (более 99 % разведанных и более 94 % оценённых российских запасов), Фёдорова Тундра (участок Большой Ихтегипахк) сульфидно-медно-никелевое в Мурманской области, а также россыпные Кондёр в Хабаровском крае, Левтыринываям в Камчатском крае, реки Лобва и Выйско-Исовское в Свердловской области[12]. Крупнейшим платиновым самородком, найденным в России, является «Уральский гигант» массой 7860,5 г, обнаруженный в 1904 г. на Исовском прииске; в настоящее время хранится в Алмазном фонде.
Самородную платину добывают на приисках (см. подробнее в статье Благородные металлы), менее богаты рассыпные месторождения платины, которые разведываются, в основном, способом шлихового опробования.
Производство платины в виде порошка началось в 1805 году английским учёным У. Х. Волластоном из южноамериканской руды.
Сегодня платину получают из концентрата платиновых металлов. Концентрат растворяют в царской водке, после чего добавляют этанол и сахарный сироп для удаления избытка HNO3. При этом иридий и палладий восстанавливаются до Ir3+ и Pd2+. Последующим добавлением хлорида аммония выделяют гексахлороплатинат(IV) аммония (NH
- 3(Nh5)2[PtCl6]→T 2N2↑+2Nh4↑+18HCl+3Pt{\displaystyle {\mathsf {3(NH_{4})_{2}[PtCl_{6}]{\xrightarrow {T}}\ 2N_{2}\uparrow +2NH_{3}\uparrow +18HCl+3Pt}}}
Получаемую таким образом губчатую платину подвергают дальнейшей очистке повторным растворением в царской водке, осаждением (NH4)2PtCl6 и прокаливанием остатка. Затем очищенную губчатую платину переплавляют в слитки. При восстановлении растворов солей платины химическим или электрохимическим способом получают мелкодисперсную платину — платиновую чернь.
Серовато-белый пластичный металл, температуры плавления и кипения — 2041,4 K (1768,3 °C) и 4098 K (3825 °C)
Кристаллическая решётка кубическая гранецентрированная, а = 0,392 нм, Z = 4, пространственная группа Fm3m[3].
Платина устойчива к вакууму и может применяться в космической технике[14].
Изотопы[править | править код]
Известны изотопы платины с массовыми числами от 166 до 204 (количество протонов 78, нейтронов от 88 до 126), и 18 ядерных изомеров.
Природная платина встречается в виде смеси из шести изотопов: 190Pt (0,014 %), 192Pt (0,782 %), 194Pt (32,967 %), 195Pt (33,832 %), 196Pt (25,242 %), 198Pt (7,163 %). Один из них слабо радиоактивен (190Pt, альфа-распад в 186Os, период полураспада 6,5⋅1011 лет). Предсказывается существование очень слабой радиоактивности ещё двух природных изотопов платины: альфа-распад 192Pt→188Os и двойной бета-распад 198Pt→198Hg, однако пока экспериментально эти распады не зарегистрированы; установлено лишь, что периоды полураспада превышают соответственно 4,7×1016 лет и 3,2×1014 лет.
По химическим свойствам платина похожа на палладий, но проявляет бо́льшую химическую устойчивость. При комнатной температуре реагирует с царской водкой:
- 3Pt+4HNO3+18HCl→3h3[PtCl6]+4NO↑+8h3O{\displaystyle {\mathsf {3Pt+4HNO_{3}+18HCl\rightarrow 3H_{2}[PtCl_{6}]+4NO\uparrow +8H_{2}O}}}
Платина медленно растворяется в горячей концентрированной серной кислоте и жидком броме. Она не взаимодействует с другими минеральными и органическими кислотами. При нагревании реагирует со щелочами и пероксидом натрия, галогенами (особенно в присутствии галогенидов щелочных металлов):
- Pt+2Cl2+2NaCl→Na2[PtCl6]{\displaystyle {\mathsf {Pt+2Cl_{2}+2NaCl\rightarrow Na_{2}[PtCl_{6}]}}}
При нагревании платина реагирует с серой, селеном, теллуром, углеродом и кремнием. Как и палладий, платина может растворять молекулярный водород, но объём поглощаемого водорода и способность его отдавать при нагревании у платины меньше.
При нагревании платина реагирует с кислородом с образованием летучих оксидов. Выделены следующие оксиды платины: чёрный PtO, коричневый PtO2, красновато-коричневый PtO3, а также Pt2O3 и смешанный Pt3O4, в котором платина проявляет степени окисления II и IV.
Для платины известны гидроксиды Pt(OH)2 и Pt(OH)4. Получают их при щелочном гидролизе соответствующих хлороплатинатов, например:
- Na2[PtCl4]+2NaOH→4NaCl+Pt(OH)2↓{\displaystyle {\mathsf {Na_{2}[PtCl_{4}]+2NaOH\rightarrow 4NaCl+Pt(OH)_{2}\downarrow }}}
- Na2[PtCl6]+4NaOH→6NaCl+Pt(OH)4↓{\displaystyle {\mathsf {Na_{2}[PtCl_{6}]+4NaOH\rightarrow 6NaCl+Pt(OH)_{4}\downarrow }}}
Эти гидроксиды проявляют амфотерные свойства:
- Pt(OH)2+2NaOH→Na2[Pt(OH)4]{\displaystyle {\mathsf {Pt(OH)_{2}+2NaOH\rightarrow Na_{2}[Pt(OH)_{4}]}}}
- Pt(OH)2+4HBr→h3[PtBr4]+2h3O{\displaystyle {\mathsf {Pt(OH)_{2}+4HBr\rightarrow H_{2}[PtBr_{4}]+2H_{2}O}}}
- Pt(OH)4+2NaOH→Na2[Pt(OH)6]{\displaystyle {\mathsf {Pt(OH)_{4}+2NaOH\rightarrow Na_{2}[Pt(OH)_{6}]}}}
- Pt(OH)4+6HBr→h3[PtBr6]+4h3O{\displaystyle {\mathsf {Pt(OH)_{4}+6HBr\rightarrow H_{2}[PtBr_{6}]+4H_{2}O}}}
Гексафторид платины PtF6 является одним из сильнейших окислителей среди всех известных химических соединений, способный окислить молекулы кислорода и ксенона:
- O2+PtF6→O2+[PtF6]−{\displaystyle {\mathsf {O_{2}+PtF_{6}\rightarrow O_{2}^{+}[PtF_{6}]^{-}}}}
Соединение O2+[PtF6]− (гексафтороплатинат(V) диоксигенила) летуче и разлагается водой на фтороплатинат(IV), небольшое количество гидратированного диоксида платины и кислород с примесью озона[15].
С помощью гексафторида платины, в частности, канадский химик Нейл Бартлетт в 1962 году получил первое настоящее химическое соединение ксенона Xe[PtF6].
C обнаруженного Н. Бартлеттом взаимодействия между Хе и PtF6, приводящего к образованию Xe[PtF6], началась химия инертных газов. PtF6 получают фторированием платины при 1000 °C под давлением.
Фторирование платины при нормальным давлении и температуре 350—400 °C даёт фторид платины(IV):
- Pt+2F2→PtF4{\displaystyle {\mathsf {Pt+2F_{2}\rightarrow PtF_{4}}}}
Фториды платины гигроскопичны и разлагаются водой.
Тетрахлорид платины с водой образует гидраты PtCl4·nH2O, где n = 1, 4, 5 и 7. Растворением PtCl4 в соляной кислоте получают платинохлористоводородные кислоты H[PtCl5] и H2[PtCl6].
Синтезированы такие галогениды платины, как PtBr4, PtCl2, PtCl2·2PtCl3, PtBr2 и PtI2.
Для платины характерно образование комплексных соединений состава [PtX4]2- и [PtX6]2-. Изучая комплексы платины, А. Вернер сформулировал теорию комплексных соединений и объяснил природу возникновения изомеров в комплексных соединениях.
Реакционная способность[править | править код]
Монета 3 рубля, 1834Платина является одним из самых инертных металлов. Она нерастворима в кислотах и щелочах, за исключением царской водки. Платина также непосредственно реагирует с бромом, растворяясь в нём.
При нагревании платина становится более реакционноспособной. Она реагирует с пероксидами, а при контакте с кислородом воздуха — со щелочами. Тонкая платиновая проволока горит во фторе с выделением большого количества тепла. Реакции с другими неметаллами (хлором, серой, фосфором) происходят менее активно. При более сильном нагревании платина реагирует с углеродом и кремнием, образуя твёрдые растворы, аналогично металлам группы железа.
В своих соединениях платина проявляет почти все степени окисления от 0 до +6, из которых наиболее устойчивы +2 и +4. Для платины характерно образование многочисленных комплексных соединений, которых известно много сотен. Многие из них носят имена изучавших их химиков (соли Косса, Магнуса, Пейроне, Цейзе, Чугаева и т. д.). Большой вклад в изучение таких соединений внес русский химик Л. А. Чугаев (1873−1922), первый директор созданного в 1918 году Института по изучению платины.
Катализатор[править | править код]
Платина, особенно в мелкодисперсном состоянии, является очень активным катализатором многих химических реакций, в том числе используемых в промышленных масштабах. Например, платина катализирует реакцию присоединения водорода к ароматическим соединениям даже при комнатной температуре и атмосферном давлении водорода. Ещё в 1821 немецкий химик И. В. Дёберейнер обнаружил, что платиновая чернь способствует протеканию ряда химических реакций; при этом сама платина не претерпевала изменений. Так, платиновая чернь окисляла пары винного спирта (этанола) до уксусной кислоты уже при обычной температуре. Через два года Дёберейнер открыл способность губчатой платины при комнатной температуре воспламенять водород. Если смесь водорода и кислорода (гремучий газ) ввести в соприкосновение с платиновой чернью или с губчатой платиной, то сначала идёт сравнительно спокойная реакция горения. Но так как эта реакция сопровождается выделением большого количества теплоты, платиновая губка раскаляется, и гремучий газ взрывается. На основании своего открытия Дёберейнер сконструировал «водородное огниво» — прибор, широко применявшийся для получения огня до изобретения спичек.
 1000 кубических сантиметров 99,9%-ной платины общей стоимостью 970 600 долларов США (в ценах на 14 июля 2012 года)[16] Рост добычи шлихового золота и платины в России в XIX веке
1000 кубических сантиметров 99,9%-ной платины общей стоимостью 970 600 долларов США (в ценах на 14 июля 2012 года)[16] Рост добычи шлихового золота и платины в России в XIX веке 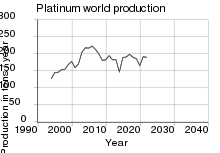 Мировое производство платины (в тоннах/год) за последние десятилетия[17]
Мировое производство платины (в тоннах/год) за последние десятилетия[17]До 1748 г. платина добывалась и производилась только на территории Америки, а в Старом Свете не была известна.
Когда платину стали завозить в Европу, её цена была вдвое ниже серебра. Ювелиры очень быстро обнаружили, что платина хорошо сплавляется с золотом, а так как плотность платины выше, чем у золота, то незначительные добавки платины позволили изготавливать подделки, которые невозможно было отличить от золотых изделий. Такого рода подделки получили столь широкое распространение, что испанский король приказал прекратить ввоз платины, а оставшиеся запасы утопить в море. Этот закон просуществовал до 1778 года. После отмены закона потребность в платине была небольшой, её использовали в основном для создания химического оборудования, приспособлений и в качестве катализаторов. Добываемой в Америке платины для этих целей было достаточно. Ни о каком значимом промышленном производстве говорить не приходилось.
В 1819 году платину впервые обнаружили на Урале близ Екатеринбурга, а в
Катализатор губчатая платина — Справочник химика 21
Газовая смесь, состоящая из водорода и кислорода при комнатной температуре, метастабильна из-за низкой скорости реакции. .. +. .. =. … Внесение в эту смесь катализатора (губчатая платина) сопровождается взрывом, так как скорость взаимодействия водорода и кислорода резко. .. Перегретая вода или переохлажденный пар также относятся к числу. .. систем. [c.270]При комнатной температуре равновесие практически полностью сдвинуто в сторону воды. Известно, однако, что гремучая смесь может пребывать сколь угодно долго без заметного образования воды. Дело опять же в высоком энергетическом барьере, необходимости большой затраты энергии на образование промежуточных стадий. Стоит, однако, ввести в гремучую смесь катализатор (губчатая платина), как реакция произойдет с очень большой скоростью— со взрывом. [c.9]
Таким образом, не углубляясь в термодинамику процесса, видим, что при 100° С половика наличного иодистого водорода разложи лась бы за 36 миллионов лет. Это уже почти астрономический промежуток времени, не оставляющий надежды заметить хотя бы следы разложения на протяжении целой человеческой жизни. Подобные уменьшения скоростей с понижением температуры часто приводят к состояниям, как говорят, кинетически заторможенным. Примером может служить смесь водорода и кислорода при комнатной температуре. Она термодинамически совершенно неустойчива и должна бы практически полностью превратиться в воду. Иными словами, в такой системе должны идти процессы, ведущие к состоянию равновесия. Они, как можно думать, и идут, но со скоростями, не допускающими обнаружения каких-либо изменений в системе в реально, доступное человеку время. В случае кинетически заторможенных систем иногда говорят о ложном равновесии. Вряд ли этот термин удачен, тем более что, например, введением подходящего катализатора (губчатая платина в случае гремучего газа) кинетическое торможение часто снимается и тогда скорость реакции может стать очень большой. На истинное равновесное состояние катализатор не может оказать никакого влияния. [c.68]
Реакция в этой неравновесной смеси водорода и кислорода может быть ускорена и без нагревания. Достаточно в эту смесь внести катализатор — губчатую платину — и взаимодействие будет протекать со взрывом. Но направление реакции и в этом случае определяется не катализатором, а условиями. В обоих [c.270]
Доказано, что катализатор не может осуществлять термодинамически невероятные реакции, он может лишь в миллионы раз ускорять медленно протекающие процессы. Так, например, потребовалось бы 1,06 1011 чтобы 0,15% гремучего газа при 9° превратилось в воду, но губчатая платина, внесенная в смесь, настолько ускоряет реакцию, что она проходит моментально, со взрывом. [c.37]
Возникновение цепных реакций происходит при использовании катализаторов. Так, необходимый для развития цепи атомарный водород может быть образован из молекулярного водорода на поверхности катализатора из губчатой платины [c.305]
В термодинамике можно найти аналогии и других видов механического равновесия — безразличного и неустойчивого. Известно, что смесь водорода с кислородом может при обычных условиях оставаться без изменения сколь угодно долго . Однако здесь равновесие неустойчиво, так как достаточно малого воздействия в виде электрической искорки или введения кусочка губчатой платины (катализатора) для того, чтобы прошла со взрывом реакция образования воды. Здесь мы как бы подтолкнули шарик, стоящий на вершине сферы (рис. П1.2, в). [c.66]
Впервые представление о цепном механизме реакций ввел Н. А. Шилов. Особенное развитие теории цепных реакций принадлежит акад. Н. Н. Семенову и его школе. По Семенову, все цепные реакции протекают через образование свободных радикалов или атомов с ненасыщенной валентностью и дальнейшее взаимодействие их с молекулами исходных веществ. Если в каждом акте цепной реакции получается только одна активная частица (как при образовании НС1), то цепь получается неразветвленной. Если образуется две и более активных частиц, то цепь разветвляется. Примером реакции с разветвленной цепью служит образование водяных паров в смеси На и Оа. Эта реакция может начаться на поверхности губчатой платины, введенной в исходную смесь. На поверхности платины (катализатор) происходит диссоциация На на атомы. Акт зарождения цепи заключается в следующем [c.48]
Губчатая платина играет роль катализатора. Для использования этого средства при получении огня в быту им был создан небольшой стеклянный прибор (по типу ранее изобретенного Киппом аппарата, носящего его имя). Водород получался приведением в контакт металлического цинка и серной кислоты. Таким образом, получение пламени и его тушение обеспечивалось поворотом крана, приводящего в контакт (или разделяющего) серную кислоту и цинк. Огниво Деберейнера можно считать прародителем современной газовой или бензиновой зажигалки. [c.29]
Скорость реакции зависит также от присутствия катализаторов — влаги, твердых пористых теп (древесного угля, губчатой платины) и некоторых минеральных веществ (кварца, глины и пр.). [c.29]
Некоторые из этих явлений, как. например, действие губчатой платины на смесь водорода и кислорода, ускоряющее влияние угля на реакции между газами, об ясняют уплотнением газов на поверхности контактного вещества и, следовательно, сбли жением частиц реагирующих веществ друг к другу, максимальной концентрацией веществ. Известно, что катализаторы тем активнее- [c.105]
Опытами Оствальда было установлено также, что губчатая платина и платиновая чернь являются неподходящими катализаторами, так как при них распадение молекулы аммиака значительно усиливается. Оказалось, однако, что катализатор, покрытый маленьким слоем губчатой платины или приобретший в процессе подобную поверхность, представляет наиболее подходящие каталитические свойства в смысле улучшения выходов окислов азота. [c.128]
О катализаторах. Смесь кислорода с водородом в обычных условиях без поднесения огня не взрывается, так как химической реакции между этими элементами практически не нроисходит. Внесем в эту смесь кусочек так называемой губчатой платины. Сразу произойдет быстрая реакция, раздастся взрыв.
Платина как катализатор гидрирования — Справочник химика 21
Парафиновые углеводороды легко изомеризуются при комнат-но»й температуре при помощи хлористого алюминия и бромида и фторида бора. В некоторых размерах реакция протекает в присутствии концентрированной (100%) серной кислоты, и очень экстенсивно при 300—450° С под давлением водорода над твердыми катализаторами гидрирования-дегидрирования, включая платину или никель и окиси вольфрама и молибдена на базе алюминия или кремний-алюминия. [c.116]Согласно этой теории, катализ происходит только при структурном и энергетическом соответствии катализируемых молекул данному катализатору. Теорией Баландина было предсказано, что реакции каталитического гидрирования бензола и дегидрирования циклогексана могут идти только на переходных металлах, имеющих гранецентрированную кубическую структуру или гексагональную структуру и притом атомные радиусы строго определенных размеров. При этих условиях шестичленные циклы образуют на октаэдрических гранях кристаллов металла шесть связей М— — С — С, валентный угол которых близок тетраэдрическому углу. Данным условиям удовлетворяют палладий, платина, иридий, родий, осмий и все они являются активными катализаторами гидрирования бензола и дегидрирования циклогексана. В то же время металлы, обладающие объемноцентрированной структурой, например тантал, вольфрам, даже при почти таких же размерах их атомных радиусов, как у платиновых металлов, а также металлы, имеющие такую же кристаллическую структуру, как платина, но иные размеры атомных радиусов, в частности серебро, золото, или не относящиеся к переходным элементам — медь, цинк,—все эти металлы не проявляют каталитической активности в вышеуказанных реакциях. Таким образом, структура поверхностных соединений бензола и циклогексана с платиновыми металлами была описана и доказана. Мало того, было, в сущности, установлено, что в условиях катализа подобные соединения легко и притом в точности воспроизводятся. Иначе катализ был бы невозможен. [c.59]
Под атмосферным давлением олефины можно гидрировать при температурах около 00—550° С. За этим пределом преобладает дегидрирование. Применение давления и катализатора дает возможность провести процесс гидрирования при комнатной температуре и даже ниже те же условия требуются для доведения до минимума дегидрирования при более высоких температурах. Гидрирование особенно усиливается при повышении давления. Довольно широкий ряд металлов относится к активным катализаторам гидрирования. Наиболее интересны никель, палладий, платина, кобальт, железо, активированная никелем медь. Первые три из них, будучи приготовлены специальным образом, активны при комнатной температуре и атмосферном давлении. Металлические катализаторы легко отравляются серо -мышьяксодержащими [c.89]
Катализаторы гидрирования [13], такие, как платина, палладий, никель и т. д. В данном случае реакция обратна гидрированию двойной связи (т. 3, реакции 15-10 и 15-12), и механизм ее, по-видимому, также обратен , хотя данных об этом немного [14]. Субстрат нагревают с катализатором до температуры примерно 300—350 °С. Реакции часто удается провести в более мягких условиях, если для связывания выделяющегося водорода использовать такие акцепторы водорода, как малеиновая кислота, циклогексен или бензол. Акцептор восстанавливается до насыщенного соединения. Сообщается, что дегидрирование 1-метилциклогексена-1- С в присутствии А Оз приводит к толуолу, в котором метка частично распределена по кольцу [15]. [c.265]
В качестве катализаторов гидрирования применяют никель, платиновую и палладиевую чернь. В последнее время используются сложные катализаторы, состояш,ие из смеси окислов хрома и некоторых других металлов (меди, цинка). Особенно активным катализатором является никель Ренея, который получается при обработке сплава никеля с алюминием (1 1) едким натром. Катализаторы применяются в мелкораздробленном состоянии, в большинстве случаев на носителе (активированный уголь, асбест) и при различных температурах. В присутствии никеля Ренея, платины и палладия гидрирование обычно проводят при комнатной температуре, а в присутствии никеля и меди — при нагревании. [c.147]
На рис. 4 и 5 показаны вулканообразные кривые для реакций гидрирования этилена и бензола. Аналогичные кривые получаются, если по оси абсцисс откладывать величину энергии связи металл — водород ( ме-н) (рис. 6 И 7). Из приведенных данных видно, что лучшим катализатором гидрирования этилена является родий, а бензола — платина. [c.134]
Эти катализаторы представляют собой оксид алюминия с равномерно распределенной по всему объему таблеток платиной. Катализаторы АП-Ю и АП-15 выпускаются в осерненном виде и перед пуском восстанавливаются одновременно с катализатором риформинга. Катализатор АП-10 является более селективным и рекомендуется для использования в системе риформинга с катализаторами серии КР. Прн нормальной работе катализаторов АП-10 и АП-15 происходит гидрирование лишь непредельных углеводородов, концентрация ароматических и нафтеновых углеводородов в риформате до и после реактора гидрирования практически одинакова. [c.32]
На поверхности катализатора бензол может адсорбироваться либо всей плоскостью, либо одним из ребер. По А. А. Баландину это будут соответственно секстетная и дублетная модели. В случае плоскостной хемосорбции (секстетная модель) размеры молекулы бензола и расстояния между атомами металла должны соответствовать друг другу. Мультиплетная теория А. А. Баландина по параметрам решеток металлов постулирует, что катализаторами гидрирования и дегидрирования могут быть только металлы никель, кобальт, медь, рутений, иридий, палладий, платина, родий, осмий,. рений. Это подтверждено экспериментально, за исключением меди, на которой гидрирование бензола часто не наблюдалось. Однако считают что это исключение кажущееся и незначительная активность меди объясняется энергетическими факторами. [c.131]
В отличие от каталитического крекинга, при каталитическом ри-форминге используют катализаторы гидрирования-дегидрирования (платина, промотированная добавками рения, иридия, германия, олова и т.д.), нанесенные на носитель (оксид алюминия с добавками хлора), которые проявляю кислотно-каталитические свойства, приводящие к реакциям изомеризации. [c.20]
Если при действии серусодержащих соединений на алюмоплатиновый катализатор происходит частичное превращение платины. в сульфид Р15 2П ], то это еще не означает полной дезактивации осерненной части металла. Так, поданным [192] сульфиды платины катализируют селективное гидрирование диолефинов и циклодиенов в более стабильные углеводороды с одной двойной связью. Возможно, что ненасыщенные поверхностные соединения, ответственные за образование кокса на платине, подвергаются гидрированию на сульфиде этого металла, что может способствовать снижению коксообразования. [c.97]
Промышленные катализаторы г
Платиновый катализатор регенерация — Справочник химика 21
Весьма важны с точки зрения экономики процесса срок службы катализатора и продолжительность межрегенерационного периода. Применительно к зарубежным установкам, работавшим на платиновом катализаторе, различали регенеративный и нерегенеративный процессы. В первом случае установка может работать на более жестком режиме, так как один из реакторов периодически отключается для регенерации. При нерегенеративном процессе запасной реактор отсутствует и продолжительность пробега определяется стабильностью активности катализатора. [c.45]Потеря активности катализатора обусловлена отложением на, его поверхности кокса. Катализатор регенерируют, продувая его газом (азотом) с небольшой концентрацией кислорода — не более 0,5% (об.). Во избежание перегрева катализатора выжиг кокса проводится вначале при 250—300 °С, затем температура повышается до 400 °С. При мягком режиме риформинга возможна длительная эксплуатация катализатора без окислительной регенерации, но с периодической обработкой платинового катализатора водородом. [c.46]
Рассмотрим теперь собственно процесс регенерации применительно к платиновым катализаторам. Эти катализаторы располагают в трех последовательных реакторах и после отравления подвергают окислительной регенерации. Поскольку катализаторы дезактивируются при перегреве, регенерацию начинают при низких концентрациях кислорода (0,2—0,4%), подаваемого в первый реактор. При таком режиме последовательно выжигается кокс в 1, 2 и 3 реакторах и процесс регенерации требует нескольких суток. [c.320]
Использование системы (IX.52) возможно при фиксированных начальных значениях Со и ро- При регенерации платинового катализатора Со меняется ступенчато в ходе процесса, что необходимо учитывать. [c.321]
Платиновый катализатор медленно покрывается коксом и сернистыми соединениями и со временем теряет свою активность. Регенерацию катализатора проводят выжиганием кокса и сернистых отложений смесью инертного газа и воздуха под давлением 1 МПа. Выжигание осуществляется в тех же реакторах в три ступени при температуре 300 -350 °С- в первой ступени, 380 — 420 — во второй и 450 — 500 — в третьей. [c.15]
Влияние неорганических примесей. Производные свинца и мышьяка, присутствующие в сырье, — сильные каталитические яды. Наличие свинца может быть обусловлено различными причинами, например использованием общего трубопровода для сырья и товарного этилированного бензина. Соединения свинца не удаляются из сырья даже при гидроочистке, и он, накапливаясь на катализаторе дезактивирует его. Платиновые катализаторы, содержащие 0,5% свинца и более, уже не удается полностью активировать при регенерации. При последующей регенерации дезактивация алюмоплатинового катализатора еще более ускоряется, и катализатор становится непригодным. Что же касается соединений мышьяка, то они полностью удаляются при гидроочистке 151. [c.22]
В течение многих лет катализаторы риформинга совершенствовались вместе с самим процессом. Наиболее широко применяемые сегодня катализаторы риформинга представляют собой один или несколько драгоценных металлов, нанесенных на оксид алюминия. Оксид алюминия в качестве носителя, используется в одной из двух кристаллических форм т) или у. г]-Форма содержит больше кислотных центров, чем -у-форма, и служит носителем для большинства монометаллических платиновых катализаторов. Она имеет более развитую начальную поверхность. При катализе и регенерациях илощадь поверхности этого носителя снижается. Уменьшение площади поверхности ограничивает срок службы катализаторов лишь несколькими циклами. [c.148]
Для нанесенных катализаторов при окислительной регенерации может наблюдаться уменьшение дисперсности активного компонента. Основной причиной изменения дисперсности активного компонента в нанесенных катализаторах, как и в случае других пористых катализаторов, является удаленность системы от состояния равновесия [1]. После периода разработки дисперсная структура катализатора находится в некотором стационарном состоянии, когда дисперсность в данных температурных условиях не изменяется. Однако в процессе окислительной регенерации перегревы и действие паров воды ускоряют рост частиц. Например [130-132], под действием высоких температур происходит укрупнение частиц платины на поверхности носителя. При нагревании до 500 °С наблюдается рост частиц платины и соответствующее уменьшение поверхности платины и степени превращения в реакции гидрирования бензола [132]. При нагревании до 600-800 °С платиновый катализатор практически полностью теряет активность, что видно из приведенных ниже данных . [c.61]
Одна из первоначальных схем подачи кислородсодержащего газа при регенерации платинового катализатора представлена на рис. 5.1. Воздух и инертный газ смешивали на входе в сепаратор 13. Смесь проходила последовательно по межтрубному пространству теплообменников 5,7, 9 п 11 через секции печи и реакторов 4, затем по трубному пространству этих же теплообменников и через холодильники 1 я 3 при 35 °С поступала в сепаратор 2. Далее смесь через колонну 6, адсорбер 8, заполненный оксидом алюминия, и сепаратор 10 подавали в циркуляционные компрессоры 12. [c.99]
| Рис. 5.2. Измененная схема подачи воздуха на регенерацию платинового катализатора на установке 35-5 |
Платина катализатор гидрогенолиза — Справочник химика 21
Относительная скорость гидрогенолиза различных С—С-свя-зей зависит от строения исходного углеводорода, свойств катализатора и условий реакции. На свежем алюмоплатиновом катализаторе гидрогенолиз идет на платине, и соотношение продуктов по реакциям (1), (2) и (3) равно 2,4 2,1 1. В условиях процесса происходит частичная дезактивация платины, и гидрогенолиз далее протекает на кислотных центрах по карбкатионному механизму [c.350]На алюмоплатиновом катализаторе гидрогенолиз идет на платине, и соотношение продуктов по реакциям (1), (2) и (3) равно 2,4 2,1 1. [c.222]
Согласно [Д.5.9], растворение атомного кислорода в решетке платины, нанесенной на уголь, приводит к снижению ее активности в реакции жидкофазного окисления. По мнению авторов [Д.6.9], механизм блокировки катализаторов платформинга при дегидрировании метилциклогексана зависит от времени. В первые 40 мин их активность можно восстановить обработкой водородом, при дальнейшей дезактивации такая обработка регенерирует катализатор лишь частично. В работе 1Д.6.20] модель обратимой блокировки применена для описания кинетики изменения активности платинового катализатора гидрогенолиза циклопентана, кобальтмолибденового на алюмосиликатном носителе катализатора диспропорционирования кумола и гидрировании оксида углерода на осмии, нанесенном да оксид алюминия. [c.258]
Возвращаясь к катализаторам, упомянутым в начале статьи, мы можем считать доказанным, что изомеризацию в случае палладированного угля вызывает не металл, а носитель, различие же действия двух катализаторов в условиях гидрирования зависит от относительной активности платины и палладия как катализаторов гидрогенолиза. В случае более активного металла скорость реакции гидрогенолиза настолько превышает скорость изомеризации, вызываемой носителем, что влияние носителя не сказывается вовсе. В случае менее активного металла скорости обеих реакций конкурируют, и наряду с гидрогенолизом идет побочная реакция, вызываемая носителем. [c.94]
Исследовано изменение селективности трех катализаторов гидрогенолиза метилциклопентана окись хрома — активированный уголь (влияние Оа), сульфид вольфрама (влияние Оа и Рц ) и платина — окись алюминия (влияние Рлг)- Кроме того, исследовано влияние Оа на селективность катализатора окись хрома — активированный уголь в реакциях деалкилирования этилбензола и циклизации к-октана. Основные результаты опытов и условия их проведения представлены в табл. 1—5. [c.297]
Таким образом, по-видимому, существуют корреляции между поведением платины, а также рассмотренных выше металлов в реакциях изотопного обмена и в других каталитических превращениях углеводородов. Подчеркнем еще то очевидное обстоятельство, что если бы платина не была плохим катализатором гидрогенолиза (это видно из рис. 4), то было бы невозможно обнаружить ее способность катализировать другие реакции углеводородов при умеренных температурах. [c.15]
Для установления природы нафтеновых углеводородов, дегидрирование деароматизированного бензина было проведено на катализаторе платина на активированном угле (Pt 10%), содержащее железо в количестве 2% с целью подавления реакции гидрогенолиза циклопентановых углеводородов, как это показано Б. А, Казанским н Г. С. Ландсбергом [6]. [c.93]
Предложено два возможных объяснения этой интересной зависимости. Во-первых, гидрогенолиз и изомеризация могут избирательно проходить на различных кристаллических плоскостях платины. Согласующиеся с этим данные получены при изучении изомеризации неопентана в изопентан. Во-вторых, возможен избирательный катализ на атомах, расположенных на углах и ребрах кристаллитов. При изменении размеров и, возможно, конфигурации кристаллитов доля таких активных атомов изменяется и соответственно меняется активность катализатора в реакциях гидрогенолиза и изомеризации. [c.93]
Суть этого механизма сводилась к тому, что гидрогенолиз циклопентана на Pt/ является типичной дублетной реакцией при реберной двухточечной адсорбции углеводорода на поверхности платины. Согласно предложенному механизму, на поверхности катализатора происходит последовательная адсорбция двух соседних атомов углерода. При этом вероятность адсорбции каждого из них пропорциональна числу связанных с ним Н-атомов. Исходя из этого, вероятности адсорбции первичного, вторичного и третичного атомов углерода равны соответственно 3, 2 и 1. Таким путем с помощью предложенной схемы предпринята попытка объяснить разные относительные скорости гидрогенолиза различных связей кольца. Однако эта схема не объясняла, почему на Pt/ не подвергаются гидрогенолизу н-пентан или циклогексан, которые могут адсорбироваться на поверхности платины совершенно таким же способом и, казалось, могли бы реагировать по тому же дублетному механизму. [c.124]
По данным Го [162], в определенных случаях наблюдается полностью неселективный гидрогенолиз циклопентанового кольца. Например, для метил- и 1,3-диметил-циклопентанов в присутствии (6—20% Pt)/АЬОз (315°С, 3 МПа) реакция протекает очень селективно, в то время как при низком содержании Pt в катализаторе (0,15—0,60%) гидрогенолиз связей кольца происходит по статистическому закону распределения. В присутствии катализаторов с большим содержанием платины при относительно низких температурах и низких давлениях водорода преобладает главным образом селективный разрыв С—С-связей кольца метилциклопентана. В то же время при неселективном разрыве на катализаторах с низким содержанием платины не наблюдается какой-либо определенной зависимости от температуры. В случае 1,3-диметилциклопентана влияние температуры сказывается более значительно. [c.130]
Действительно, в 1,3-диметилциклопентане метильные группы вступают в конформационные 1,2- и 1,3-взаимодействия друг с другом или с атомами водорода кольца. Если при образовании переходного состояния эти взаимодействия растут или уменьшаются, то соответственно изменяется и энергия активации. Секстетно-дублетный механизм гидрогенолиза циклопентанов на платине дает возможность хотя бы качественно рассмотреть геометрию образовавшегося переходного состояния, адсорбированного на поверхности катализатора. Согласно этому механизму [154], при адсорбции все пять атомов углерода кольца располагаются в междоузлиях грани (111) решетки платины, т, е. на правильном шестиугольнике. При этом длина четырех С—С-связей кольца практически не изменяется, но пятая связь по очевидным геометрическим соображениям оказывается растянутой. Именно по этой ослабленной связи и происходит гидрогенолиз. Такой подход дает возможность рассмотреть изменение конформационных взаимодействий [c.144]
Рассмотрим теперь с этих позиций результаты, полученные при изучении гидрогенолиза гомологов циклопентана. В проточной системе после установления стационарного режима концентрация водорода на поверхности катализатора относительно мала, так как значительная часть его вытесняется с поверхности платины углеводородом. Наоборот, при импульсной подаче вещества молекулы реагента попадают на поверхность, которая в несравненно большей степени или даже целиком заполнена водородом. Такие значительные различия в концентрации одного из реагентов, вероятно, и сказываются специфически на ходе реакции. Для простоты обсудим возможности гидрогенолиза алкилциклопентанов в условиях обоих методов на примере метилциклопентана. В соответствий с секстетно-дублетным меха- [c.149]
Тщательное изучение гидрогенолиза [53] метилциклопентана проведено в присутствии промышленного катализатора гидроформинга, так называемого двухфункционального катализатора крекинга, — металлы группы платины на носителях кислого характера (табл. 8). [c.256]
Изучение реакции изомеризации гексанов с помощью меченых атомов С позволило определить соотнощение механизмов реакции сдвига связи и циклической изомеризации в зависимости от свойств катализатора. Оценка размеров кристаллитов платины в катализаторе показала, что в случае кристаллитов размером менее 2 нм преобладают циклическая изомеризация и неселективный гидрогенолиз метилциклопентана, в то время как на более крупных кристалл
Платиновые катализаторы носители — Справочник химика 21
Платиновый катализатор. Носитель (силикагель, пемза) пропитывают раствором платинохлористоводородной кислоты Н2Р С1б, содержащим 15% платины от массы носителя, в течение 12— 14 ч. Затем раствор сливают, носитель сушат на водяной бане и, пропуская через него водород, восстанавливают платину при температуре 120—140°. Охлаждение ведут также в струе водорода. [c.92]Другая возможность для осуществления, говоря словами Вант-Гоффа, несимметричных условий опыта состояла в применении асимметричных кристаллов как катализаторов. На такую возможность было указано Остромысленским в 1908 г. [14]. Попытки осуществить эту идею были предприняты, однако, много позднее. В 1932 г. Шваб и сотрудники сообщили [27], что им удалось на никелевых и платиновых катализаторах, носителем для которых был оптически активный кварц, осуществить дегидратацию рацемического вторичного бутилового алкоголя и некоторых других алкоголей, причем остаток приобретал активность, по знаку отвечающую знаку вращения примененного кварца. Однако это по сути дела пример одного из новых методов расщепления рацематов, [c.73]
Одним из перспективных гидрогенизационных процессов производства масел является гидроизомеризация высокомолекулярных парафиновых углеводородов. Процесс ведется на платиновом катализаторе (носитель — окись алюминия или алюмосиликат), давление водорода [c.163]
Таким образом, условием получения высокоактивного платинового катализатора изомеризации является применение носителя, обладающего высокой кислотностью. [c.17]
В качестве возможных причин токсичности кокса для бифункциональных платиновых катализаторов рассматриваются различие структур коксовых отложений, изменение распределения кокса между металлом и носителем при изменении условий коксования, избирательное отравление металлических центров, катализирующих данную реакцию. [c.38]
Исследования ряда авторов показали, что нанесением никеля, кобальта, палладия и платины на носители, обладающие кислотными свойствами, можно синтезировать катализаторы изомеризации парафиновых углеводородов [36]. В наших исследованиях была изучена реакция изомеризации парафиновых углеводородов на алюмоплатиновых и алюмо-палладиевых катализаторах, промотированных фтором. Было показано, что платиновые катализаторы отличаются большой устойчивостью к действию ядов (сернистых и азотистых соединений) и лучшей регенерационной способностью (табл. 2.6). На основании проведенной работы в качестве металлического компонента катализатора была рекомендована платина. [c.52]
Катализаторы изомеризации представляют собой систему металл — носитель, поэтому ввиду избирательного характера действия каталитических ядов изучалось действие соединений в модельных реакциях, характеризующих функции металлических и кислотных центров катализаторов. Состояние металлических центров характеризовала реакция дегидрирования циклогексана, состояние кислотных центров носителя — изомеризация о-ксилола, н-пентана, н-гексана, метилциклопентана. Несмотря на некоторую условность подобного разделения функций катализатора, оно оказалось весьма полезным для изучения явлений отравления. Известно, что при давлении водорода на платиновом катализаторе сернистые и азотистые соединения превращаются соответственно в сероводород и аммиак. (Концентрация сернистых и азотистых соединений в последующем изложении указана в пересчете на элементарные серу и азот.) [c.85]
При сравнении таких катализаторов гидрокрекинга, как иридий, осмий, платина, рутений и родий на кислотных носителях было показано, что при содержании металлов в катализаторе в количестве 0,5% высшей активностью обладал родиевый катализатор, однако наибольший выход углеводородов С5 получен на платиновом катализаторе. [c.320]
В течение многих лет катализаторы риформинга совершенствовались вместе с самим процессом. Наиболее широко применяемые сегодня катализаторы риформинга представляют собой один или несколько драгоценных металлов, нанесенных на оксид алюминия. Оксид алюминия в качестве носителя, используется в одной из двух кристаллических форм т) или у. г]-Форма содержит больше кислотных центров, чем -у-форма, и служит носителем для большинства монометаллических платиновых катализаторов. Она имеет более развитую начальную поверхность. При катализе и регенерациях илощадь поверхности этого носителя снижается. Уменьшение площади поверхности ограничивает срок службы катализаторов лишь несколькими циклами. [c.148]
Для нанесенных катализаторов при окислительной регенерации может наблюдаться уменьшение дисперсности активного компонента. Основной причиной изменения дисперсности активного компонента в нанесенных катализаторах, как и в случае других пористых катализаторов, является удаленность системы от состояния равновесия [1]. После периода разработки дисперсная структура катализатора находится в некотором стационарном состоянии, когда дисперсность в данных температурных условиях не изменяется. Однако в процессе окислительной регенерации перегревы и действие паров воды ускоряют рост частиц. Например [130-132], под действием высоких температур происходит укрупнение частиц платины на поверхности носителя. При нагревании до 500 °С наблюдается рост частиц платины и соответствующее уменьшение поверхности платины и степени превращения в реакции гидрирования бензола [132]. При нагревании до 600-800 °С платиновый катализатор практически полностью теряет активность, что видно из приведенных ниже данных . [c.61]
Регенерацию [Металлических контактов и, в частности, никелевого, производят промывкой щелочами, спиртом, кислотами и другими растворителями [59, 60]. Полную регенерацию отработанного катализатора осуществляют переплавкой. При этом органические примеси выгорают, а над расплавом собирается шлак, содержащий NiO и АЬОз [59, 61]. Необратимо отравленные платиновые катализаторы на силикатном носителе, серебряные на пемзе, ванадиевые массы БАВ и СВД регенерируют извлечением из них платины, серебра и ванадия кислотами или щелочами с последующим использованием металлов. [c.69]
X10 —окись алюминия — носитель алюмо-платиновых катализаторов [c.383]
Известны промышленные процессы изомеризации на хлористом алюминии в его присутствии можно осуществлять реакцию при низких температурах — от 50 до 150° С. Поскольку процессы подробно описаны [8, 75], далее они не рассматриваются. Весьма активно влияют на реакцию изомеризации катализаторы гидрогенизации и дегидрирования (сульфид вольфрама, окись молибдена, платина и др.) [76—79]. В промыщленности широко применяют платиновые и палладиевые катализаторы на кислых носителях — синтетических алюмосиликатах и фторированной
Платиновые катализаторы синтез HN — Справочник химика 21
В 1867 г. Г. Дикон разработал получивший всемирную известность хлорный процесс—получение хлора окислением НС1 воздухом над медными соединениями. В 1867 г. А. Гофман получил впервые формальдегид окислением метилового спирта воздухом над платиной. В 1871 г. М. Г. Кучеров открыл замечательную реакцию гидратации ацетилена разбавленной серной кислотой в присутствии ртутных солей, которая лежит в основе многих каталитических превращений ацетилена, его гомологов и производных. В 1875 г. Кл. Винклер разрешил, наконец, проблему каталитического окисления SO, в SO3 воздухом в присутствии платинового катализатора, разработав промышленный способ контактного синтеза серной кислоты. Этот вопрос имеет многолетнюю интересную историю, начиная с работ И. Деберейнера и патента П. Филлипса в 1831 г., рекомендовавшего также платиновый катализатор, по потерпевшего неудачу из-за неумения проводить очистку сернистого газа от контактных ядов. В 1877 г. М. М. Зайцев опубликовал свои исследования по восстановлению различных органических соединений водородом в гетерогенной фазе над платиной или палладием, предвосхитив по существу методику гидрирования, разработанную гораздо позднее. В том же 1877 г. Н. А. Меншуткин начал свои классические исследования по приложению химической кинетики к органическим ссединениям в области изучения скоростей этерификации различных карбоновых кислот спиртами. В 1878 г. А. М. Бутлеров открыл реакцию уплотнения олефинов под действием серной кислоты, что явилось преддверием к синтезу высокомолекулярных соединений и процессов алкили-рования, имеющих сейчас огромное значение. Г. Г. Густавсон провел ряд исследований по каталитическому действию галогенидов алюминия на органические соединения, несколько опередив работы Ш. Фриделя и Дж. Крафтса. [c.15]Этот метод получения применим для синтеза первичных алкильных эфиров молочной кислоты, но он дает неудовлетворительные результаты при синтезе ее р-металлилового эфира, так как сильная минеральная кислота является катализатором перегруппировки металлилового спирта в изомасляный альдегид. Метиловый эфир молочной кислоты можно удобно (с 80—85%-]1ым выходом) синтезировать нагреванием 1 моля полимера, полученного конденсацией молочной кислоты, с 2,5—5 молями метилового спирта и небольшим количеством серной кислоты при 100° в течение 1—4 час. в толстостенной склянке, например, в такой, какие используются для каталитического гидрирования с применением платинового катализатора. [c.17]
Активность катализатора определяет собой степень ускорения данной реакции по сравнению с протеканием ее без катализатора при тех же условиях. Так, например, скорость окисления сернистого газа на платиновом катализаторе при / = 500—600° С увеличивается в сотни тысяч раз ( 10 раз) по сравнению со с1этого процесса, протекающего без катализатора, на ванадиевых — несколько меньше, а на железных—еще меньше реа.кция окисления аммиака до окиси азота без катализаторов ничтожно мала, в присутствии же платино-радиевых катализаторов она ускоряется в миллионы раз и заканчивается в десятитысячные доли секунды если реакция синтеза аммиака при 450° С и давлении 300—500 атм достигает равновесного состояния без катализатора через несколько часов, то в присутствии одних катализаторов при тех же условиях равновесие наступает через несколько минут, в присутствии других — через несколько секунд, в присутствии третьих процесс синтеза заканчивается и доли секунды. [c.230]
Газы, образующиеся в результате наиболее распространенных в настоящее время каталитических риформинг-процессов, мало интересны с точки зрения их пригодности в качестве исходного материала для промышленности органического синтеза, так как они почти не содержат олефинов. В табл. Зв приведены результаты крекинга методом платформинга (при 450° и 50 ат) в присутствии водорода и платинового катализатора. [c.30]
Изучено влияние различных условий синтеза углеродного материала на его фазовый состав. Синтез углеродного материала проводили из смеси метан-воздух, либо из смеси h3- O-N2 ( та же смесь метан-воздух, пропущенная через платиновый катализатор) или из паров метанола. Кроме состава исходной газовой смеси менялся материал катодов. [c.93]
Переходные металлы являются активными катализаторами в подавляющем большинстве окислительно-восстановительных реакций. Железо, например, является классическим катализатором синтеза аммиака. Кобальт, никель, медь и металлы платиновой группы проявляют высокую активность в процессах гидрирования и дегидрирования, а также окисления. Серебро является практически единственным катализатором парциального окисления (например, этилена до его окиси). [c.429]
С промышленной точки зрения метан является более перспективным исходным материалом для синтеза цианистого водорода, чем ацетилен. Реакции (1) и (2) весьма эндотермичны, и в случае применения обычного трубчатого реактора интенсивный подвод большого количества тепла для поддержания температуры 1500° представляет в промышленных условиях очень значительные трудности. Выше упоминалось о проведении реакции в электрической дуге как об одном из решений этой проблемы. Вторым решением является сожжение части реагирующих газов внутри реактора. Последний способ был применен при осуществлении реакции (2) и используется сейчас при промышленном производстве цианистого водорода из нефтяного сырья. Этот метод разработан в начале тридцатых годов Андрус-совым [6], который пропускал при 1000° над платиновым катализатором смесь аммиака, кислорода и метана, полученного гидрированием угля или из коксовых газов. В смеси должно находиться достаточное количество кислорода, чтобы могла протекать реакция [c.376]
Побочный водород риформинга. Для использовапия побочного газа с высоким содержанием водорода, образующ егося при риформинге на платиновом катализаторе, в качестве сырья в производстве жидкого аммпака или в некоторых каталитических процессах нефтепереработки требуется эффективная его осушка. На установках синтеза аммиака присутствие воды приводит к вымерзанию или образованию гидратов в низкотемпературных узлах секции очистки, что ухудшает условия теплопередачи и гидравлические характеристики аппаратуры. При каталитических процессах нефте- [c.80]
Активным катализатором при этом является платина. Реакция не сопровождается образованием побочных продуктов. По литературным данным [81, 82] выход цианистого водорода превышает 80% на введенный аммиак и 91% на метан. Реакция эндотермична. Высокая температура, необходимая для инициирования и дальнейшего протекания реакции, должна поддерживаться при помощи внешнего обогрева. Полузаводская установка с применением обогреваемого газом реактора, содержащего керамические трубы, облицованные платиновым катализатором, эксплуатировалась в ФРГ [6]. Установлено [3, 4], что если наряду с метаном и аммиаком реакционная смесь содержит кислород, то ц
