Принцип действия аккумулятора: устройство, виды и принцип работы АКБ, а также срок службы и характеристики батареи – Устройство и принцип работы аккумуляторной батареи автомобиля
- 12.10.2020
Принцип действия аккумулятора | Аккумуляторные батареи
Страница 3 из 26
1.4. Принцип действия аккумулятора
В настоящее время выпускаются следующие типы электрических аккумуляторов: свинцово-кислотные, щелочные железо-никелевые, кадмий-никелевые и серебряно-цинковые аккумуляторы.
Наиболее массовыми типами аккумуляторов являются свинцово-кислотные автомобильные батареи и тяговые щелочные железо-никелевые аккумуляторы. Серебряно-цинковые аккумуляторы находят ограниченное применение из-за дороговизны и дефицитности исходных материалов и сравнительно малого срока службы.
Кислотные аккумуляторы представляют собой сосуд, заполненный электролитом соответствующей плотности, т. е. раствором серной кислоты h3SO4 в дистиллированной воде, в который погружен блок пластин из чистого свинца РЬ и блок пластин из перекиси свинца РЬО2 (рис. 1.7). Вследствие постоянно происходящей диссоциации молекул кислоты в электролите заряженного аккумулятора имеются ионы водорода Н2 (катионы) и ионы кислотного остатка SO4 (анионы). Если пластины аккумулятора замкнуть на некоторое сопротивление, то через него потечет ток. Отрицательно заряженные ионы SO4 будут стремиться к пластинам из чистого свинца, заряженным положительно. Ионы водорода, имеющие положительный заряд, будут стремиться к отрицательным пластинам, содержащим двуокись свинца. Пластины из свинца принято называть отрицательными, а из двуокиси свинца – положительными.
у отрицательной пластины
Pb + SO4 = PbS04;
у положительной пластины
РЬО2 + h3+h3SO4=PbSO4+2h3O.

Рис. 1.7. Устройство и принцип действия кислотного аккумулятора.
Из рассмотренных химических реакций видно, что при разрядке кислотных аккумуляторов на всех пластинах выделяется сернокислый свинец PbSO4 и уменьшается концентрация электролита (вследствие диссоциации кислоты и выделения воды).
Сернокислый свинец обладает двумя недостатками. Во-первых, при интенсивном образовании сернокислого свинца возможно коробление или выпучивание пластин, а также «высыпание» из пластин активной массы, так как объем сернокислого свинца больше объема исходных продуктов, из которых он образуется. Во-вторых, сернокислый свинец по истечении некоторого времени кристаллизуется в нерастворимое вещество. Часть пластины, которая оказалась покрытой кристаллизовавшимся сернокислым свинцом, не участвует в химических реакциях. Вследствие этого снижается полезная емкость аккумулятора. Такое явление носит название сульфатации кислотных аккумуляторов. Для того чтобы избежать явления сульфатации, кислотные аккумуляторы не следует хранить в незаряженном состоянии, нельзя допускать недозарядку аккумуляторов. При коротком замыкании в результате бурной химической реакции и интенсивного выделения сернокислого свинца происходит коробление пластин кислотного аккумулятора.
PbS04 + h3 = Pb + h3S04;
у положительной пластины
PbS04 + 2 Н20 + S04 = Рb02 + 2 Н2 + 2 h3SO4.
Следовательно, при зарядке аккумуляторов происходит разложение сернокислого свинца на исходные продукты, а также восстановление концентрации электролита. Очевидно, что окончанием зарядки аккумуляторов можно считать такой момент, когда весь сернокислый свинец разложился и концентрация электролита восстановилась до нормальной. При дальнейшей зарядке потребляемая аккумулятором электрическая энергия будет расходоваться на разложение воды, имеющейся в электролите. Вода разлагается на водород и кислород. Кислород, как наиболее активный газ, производит окисление металлов, имеющихся в аккумуляторе. Водород выделяется в атмосферу. Поэтому на поверхности электролита появляются пузырьки, создающие впечатление «кипения» электролита. В смеси с воздухом водород образует взрывчатый гремучий газ, который должен быть немедленно удален из аккумуляторного помещения.
Напряжение, создаваемое аккумулятором на зажимах, определяется уравнениями:
U = E-IPr;
при зарядке
U=E+Iзар r
где Е – ЭДС аккумулятора;
Ip,Iзар – соответственно ток разрядки и зарядки аккумулятора;
r – внутреннее сопротивление аккумулятора.
Кислотные аккумуляторы имеют небольшое внутреннее сопротивление, поэтому напряжение на зажимах аккумулятора незначительно снижается даже при больших токах нагрузки. В среднем сопротивление кислотного аккумулятора составляет 0,005 Ом и является величиной, зависящей от плотности электролита, а также от габаритов аккумуляторов (чем больше габариты, тем меньше сопротивление). С уменьшением плотности электролита, т. е. с увеличением степени разряда, ЭДС кислотных аккумуляторов уменьшается, а внутреннее сопротивление увеличивается. Вследствие этого напряжение аккумулятора в начале разрядки понижается незначительно, а к концу падает быстро.
Электролитом их является раствор едкого калия КОН в дистиллированной воде (плотность электролита 1,19—1,21). В качестве активной массы положительных пластин служит гидрат окиси никеля Ni(OH)3, а активной массы отрицательных – губчатый кадмий Cd (рис. 1.8).

Рис. 1.8. Устройство и принцип действия щелочного кадмиево-никелевого аккумулятора
При разрядке аккумулятора анионы щелочного остатка ОН стремятся к пластинам из чистого кадмия. Избыточные электроны кислотного остатка направляются во внешнюю цепь и к пластинам из гидрата окиси никеля, где они нейтрализуются катионами калия. Таким путем создается разрядный ток аккумулятора.
При разрядке щелочного аккумулятора происходят следующие химические реакции:
у отрицательной пластины
Cd + 20H = Cd(OH)2;
у положительной пластины
Ni (ОН)3 + К = Ni (OH)a + КОН.
Из данных реакций видно, что при разрядке щелочного аккумулятора кадмий переходит в гидроокись кадмия Cd(OH)2, а трехатомный гидрат окиси никеля Ni(OH)3 – в двухатомную гидроокись никеля Ni(ОН)2. Эти вещества не обладают отрицательными свойствами, поэтому щелочные аккумуляторы не требуют тщательного ухода в эксплуатации, могут быть длительно незаряженными, мало разрушаются при коротких замыканиях.
у отрицательной пластины
Cd(OH)2 + 2K = 2KOH+Cd;
у положительной пластины
Ni(OH)2 + OH = Ni(OH)3.
После переработки всех веществ, участвующих в химических реакциях, при зарядке щелочных аккумуляторов происходит разложение воды электролита и «кипение» аккумулятора.
Электрический аккумулятор. Строение и принцип работы.
Электри́ческий аккумуля́тор — химический источник тока многоразового действия, основная специфика которого заключается в обратимости внутренних химических процессов, что обеспечивает его многократное циклическое использование (через заряд-разряд) для накопления энергии и автономного электропитания различных электротехнических устройств и оборудования.
Принцип действия аккумулятора основан на обратимости химической реакции. Работоспособность аккумулятора может быть восстановлена путём заряда, то есть пропусканием электрического тока в направлении, обратном направлению тока при разряде.
Несколько аккумуляторов, объединенных в одну электрическую цепь, составляют аккумуля́торную батаре́ю.
Для того чтобы ясно понять суть работы электрических аккумуляторов, давайте разберёмся с его устройством и общим принципом действия. И так — в основу работы всех химических источников электропитания заложены две составляющие: это пара электродов и электролит. Всё это находится в ёмкости, которая служит корпусом для электрического аккумулятора.
Электрический ток — это упорядоченное движение заряженных частиц (в твёрдых веществах, это электроны, а в жидких и газообразных, это ионы). Ток не может существовать без воздействия электродвижущей силы Э.Д.С. (разности потенциалов или напряжения). Значит, между электродами что-то должно создавать эту Э.Д.С. А создаёт её следующий процесс!
И так, у нас имеется сосуд с двумя электродами, погружённых в жидкий электролит. С точки зрения химии, в этом сосуде происходит растворение одного электрода (под действием кислотной или щелочной среды электролита) и восстановление (отложение слоя) другого. При этом от растворяющегося электрода (металла) отрываются ионы этого вещества, которые с собой уносят положительный заряд. А электроны, ранее принадлежащие этому атому металла и не имеющие возможности уйти с ним, остаются на этом электроде.
На другом же электроде будет происходить противоположный процесс, те ионы, которые были оторваны от первого, переходят на второй, неся в себе положительный заряд и постоянно прибавляя его к электроду. Весь этот химический процесс окислительно-восстановительной реакции сопровождается превращением одних веществ в другие, при заряде, и взаимообратный, при разряде электрического аккумулятора.
В итоге получается, что под воздействием внешнего источника электрического поля (в случае процесса заряда) мы принудительно превращаем одни вещества в другие, а при подключении к клеммам электрической нагрузки (создавая тем самым замкнутую цепь), мы позволяем накопленной электроэнергии выйти, по средствам обратного химического превращения веществ. Следует заметить, что электролит в этой электрохимической системе является переносчиком положительного заряда (ионов, оторванных от электрода), и они перемещаются внутри самого аккумулятора. А отрицательный заряд (то есть электроны) будет транспортироваться по внешней цепи, вне аккумулятора.
устройство, принцип действия, достоинства и недостатки
 Своё название щелочные аккумуляторы получили от вида электролита, необходимого для их работы. Основными разновидностями электролита, используемыми в щелочных аккумуляторах, являются едкий калий (КОН) и едкий натрий (NaOH). При сравнении щелочных аккумуляторов с кислотными батареями, очевидно, что аккумуляторы, работающие на электролите, имеют некоторые преимущества. Однако недостатки у них также существуют. Особенности работы щелочных аккумуляторов делают их незаменимыми в некоторых производственных отраслях.
Своё название щелочные аккумуляторы получили от вида электролита, необходимого для их работы. Основными разновидностями электролита, используемыми в щелочных аккумуляторах, являются едкий калий (КОН) и едкий натрий (NaOH). При сравнении щелочных аккумуляторов с кислотными батареями, очевидно, что аккумуляторы, работающие на электролите, имеют некоторые преимущества. Однако недостатки у них также существуют. Особенности работы щелочных аккумуляторов делают их незаменимыми в некоторых производственных отраслях.
Устройство щелочных аккумуляторов
Среди аккумуляторов, работающих при помощи щелочного раствора (электролита), наиболее часто используются два их вида – никель-кадмиевый и никель-металлогидридный. В каждом них положительный электрод состоит из гидроокиси никеля (NiOOH), с добавками графита и окиси бария. Каждая из добавок улучшает качество работы аккумулятора. Графит увеличивает электропроводность электрода, а окись бария увеличивает срок работы аккумулятора. 
Массы отрицательных электродов каждого вида щелочного аккумулятора имеют различный состав. У металлогидридного аккумулятора отрицательный электрод изготовлен из порошкообразного железа и его окислов. В основной состав отрицательного электрода входит также сернистое железо и сернокислый никель. Если батарея никель-кадмиевая, то отрицательный электрод состоит из смеси порошков железа и кадмия.
В качестве электролита преимущественно используют раствор едкого калия (20 %), в который добавлен моногидрат лития, увеличивающий срок эксплуатации щёлочного аккумулятора. Необходимое количество – 20-30 г/литр раствора.
Химические процессы, происходящие при работе щелочного аккумулятора
При использовании щелочного аккумулятора, то есть, при его разряде, гидроокись никеля положительного электрода вступает в реакцию с ионами электролита. Результатом данной реакции становится образование Ni(OH)2 — гидрата закиси никеля
Одновременно подобный процесс происходит на отрицательном электроде, только на нём образуются гидраты окисей кадмия и железа. Разность потенциалов, составляющая около 1,45 вольта, обеспечивается протеканием тока по контурам внешней и внутренней сети. Таков принцип работы щелочного аккумулятора.
При зарядке щелочного аккумулятора происходит обратный химический процесс – при воздействии тока положительные электроды окисляются, превращая гидрат закиси никеля в гидроокись никеля. Отрицательный электрод при этом восстанавливается, в его массе образуется кадмий и железо.
Главная особенность этих процессов в том, что вещества, образующиеся в процессе электрохимических реакций, в реакцию друг с другом не вступают. Они практически не растворяются в электролите. Благодаря такому поведению веществ расход электролита отсутствует, а его плотность не изменяется. 
Особенности эксплуатации щёлочных аккумуляторов
Начиная с момента, когда аккумулятор начинает использоваться по назначению, то есть, к батарее подключается нагрузка, напряжение весьма быстро падает до 1,3 вольта, а затем продолжает снижаться уже медленно. В момент, когда оно уменьшается до 1 вольта, его работу необходимо останавливать.
Далее батарею эксплуатировать не следует, так как её использование при напряжении ниже 1 вольта, приводит к потере ёмкости аккумулятора. Уменьшится и срок его эксплуатации. Повседневный уход за щелочными аккумуляторами ничем не отличается от их кислотных аналогов. Необходима систематическая подзарядка и контроль уровня электролита.
Применение щёлочных аккумуляторов, их достоинства и недостатки.
Щёлочные аккумуляторы находят применение в устройствах систем аварийного электроснабжения, в оборудовании локомотивов и вагонов для пассажиров. Их используют в устройствах электропогрузчиков, электроинструментах и портативных электроинструментах. Телефоны и фотоаппараты также оборудуются щёлочными батареями. Правильно выбрать аккмуляторную батарею можно, протитав статью на нашем сайте.
Основными достоинствами батарей данной конструкции считают:
— Длительный срок службы;
— Небольшой вес;
— Небольшой саморазряд.
Существенным минусом щелочных аккумуляторов является небольшой КПД – всего 55%. Наличие эффекта памяти, приводящего к потере ёмкости.
Зарядка аккумулятора схема и принцип действия
Как происходит зарядка аккумулятора? Схема этого устройства сложна или нет, для того чтобы сделать устройство своими руками? Отличается ли принципиально зарядное устройство для автомобильного аккумулятора от того, что применяется для мобильных телефонов? На все поставленные вопросы мы попытаемся ответить далее в статье.
Общие сведения
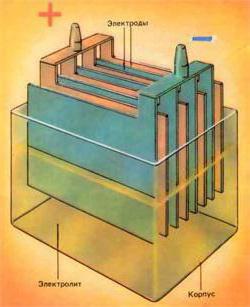 Аккумулятор играет очень важную роль в функционировании устройств, агрегатов и механизмов, для работы которых необходимо электричество. Так, в транспортных средствах он помогает запустить двигатель машины. А в мобильных телефонах батареи позволяют нам совершать звонки.
Аккумулятор играет очень важную роль в функционировании устройств, агрегатов и механизмов, для работы которых необходимо электричество. Так, в транспортных средствах он помогает запустить двигатель машины. А в мобильных телефонах батареи позволяют нам совершать звонки.Зарядка аккумулятора, схема и принципы работы данного устройства рассматриваются даже в школьном курсе физики. Но, увы, уже к выпуску многие эти знания успевают позабыть. Поэтому спешим напомнить, что в основу работы аккумулятора положен принцип возникновения разности напряжения (потенциалов) между двумя пластинами, которые специально погружаются в раствор электролита.
Первые батареи были медно-цинковыми. Но с того времени они существенно улучшились и модернизировались.
Как устроена аккумуляторная батарея
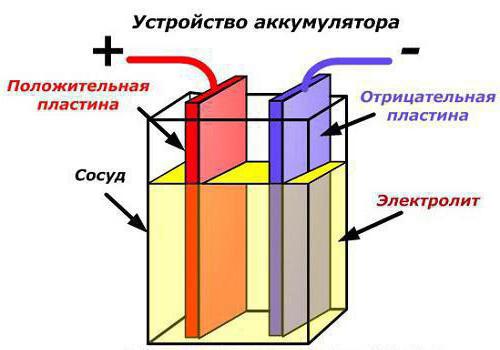 Единственный видимый элемент любого устройства – корпус. Он обеспечивает общность и целостность конструкции. Следует отметить, что наименование «аккумулятор» может быть полноценно применено только к одной ячейке батареи (их ещё называют банками), а том же стандартном автомобильном аккумуляторе на 12 В их всего шесть.
Единственный видимый элемент любого устройства – корпус. Он обеспечивает общность и целостность конструкции. Следует отметить, что наименование «аккумулятор» может быть полноценно применено только к одной ячейке батареи (их ещё называют банками), а том же стандартном автомобильном аккумуляторе на 12 В их всего шесть.Возвращаемся к корпусу. К нему выдвигают жесткие требования. Так, он должен быть:
- стойким к агрессивным химическим реагентам;
- способным переносить значительные колебания температуры;
- обладающим хорошими показателями вибростойкости.
Всем этим требованиям отвечает современный синтетический материал – полипропилен. Более детальные различия следует выделять только при работе с конкретными образцами.
Принцип работы
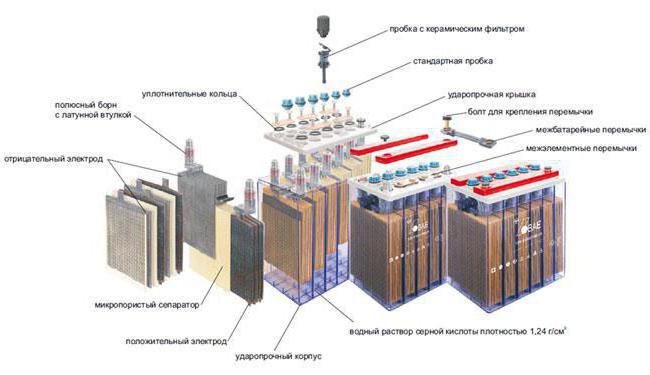 В качестве примера мы рассмотрим свинцово-кислотные батареи.
В качестве примера мы рассмотрим свинцово-кислотные батареи.Когда есть нагрузка на клемму, то начинает происходить химическая реакция, которая сопровождается выделением электричества. Со временем батарея будет разряжаться. А как она восстанавливается? Есть ли простая схема?
Зарядка аккумулятора не является чем-то сложным. Необходимо осуществлять обратный процесс – подаётся электричество на клеммы, вновь происходят химические реакции (восстанавливается чистый свинец), которые в будущем позволят использовать аккумулятор.
Также во время зарядки происходит повышение плотности электролита. Таким образом батарея восстанавливает свои начальные свойства. Чем лучше были технология и материалы, которые применялись при изготовлении, тем больше циклов заряда/разряда может выдержать аккумулятор.
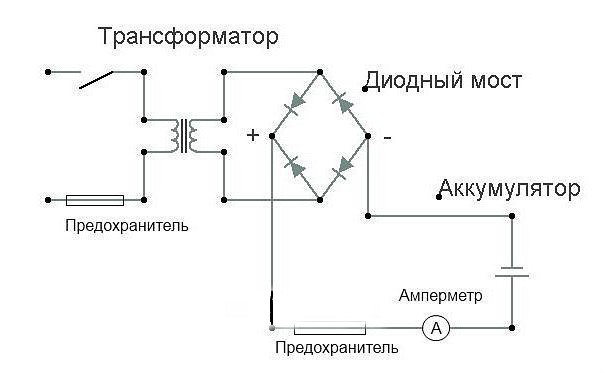
Какие электрические схемы зарядки аккумуляторов существуют
Классическое устройство делают из выпрямителя и трансформатора. Если рассматривать все те же автомобильные батареи с напряжением в 12 В, то зарядки для них обладают постоянным током примерно на 14 В.
Почему именно так? Такое напряжение необходимо для того, чтобы ток мог идти через разряженный автомобильный аккумулятор. Если он сам имеет 12 В, то устройство той же мощности ему помочь не сможет, поэтому и берут более высокие значения. Но во всём необходимо знать меру: если слишком завысить напряжение, то это пагубно скажется на сроке службы устройства.
Поэтому при желании сделать прибор своими руками, необходимо для машин искать подходящие схемы зарядки автомобильных аккумуляторов. Это же относится и к другой технике. Если необходима схема зарядки аккумулятора литий-ионного, то тут необходимо устройство на 4 В и не больше.
Процесс восстановления
Допустим, у вас есть схема зарядки аккумулятора от генератора, по которой было собрано устройство. Батарея подключается и сразу же начинается процесс восстановления. По мере его протекания будет расти внутреннее сопротивление устройства. Вместе с ним будет падать зарядный ток.
Когда напряжение приблизится к максимально возможному значению, то этот процесс вообще практически не протекает. А это свидетельствует о том, что устройство успешно зарядилось и его можно отключать.
Технологические рекомендации
Необходимо следить, чтобы ток аккумулятора составлял только 10% от его емкости. Причем не рекомендовано ни превышать этот показатель, ни уменьшать его. Так, если вы пойдёте по первому пути, то начнёт испаряться электролит, что значительно повлияет на максимальную емкость и время работы аккумулятора. На втором пути необходимые процессы не будут происходить в требуемой интенсивности, из-за чего негативные процессы продолжатся, хотя и в несколько меньшей мере.
Зарядка
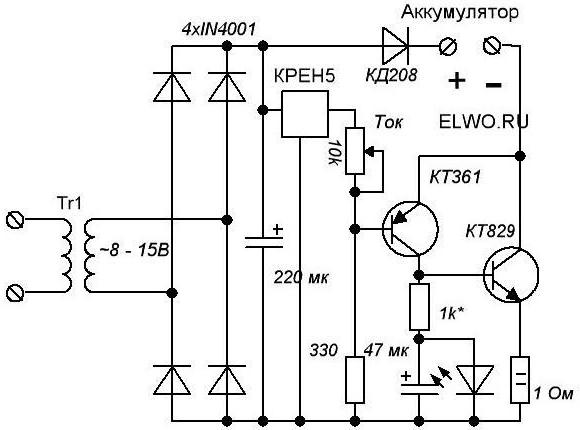 Описываемое устройство можно купить или собрать своими руками. Для второго варианта нам понадобятся электрические схемы зарядки аккумуляторов. Выбор технологии, по которой она будет делаться, должен происходить зависимо от того, какие батареи являются целевыми. Понадобятся такие составляющие:
Описываемое устройство можно купить или собрать своими руками. Для второго варианта нам понадобятся электрические схемы зарядки аккумуляторов. Выбор технологии, по которой она будет делаться, должен происходить зависимо от того, какие батареи являются целевыми. Понадобятся такие составляющие:- Ограничитель тока (конструируется на балластных конденсаторах и трансформаторе). Чем большего показателя удастся достичь, тем значительней будет величина тока. В целом, для работы зарядки этого должно хватить. Но вот надёжность данного устройства весьма низкая. Так, если нарушить контакты или что-то перепутать, то и трансформатор, и конденсаторы выйдут из строя.
- Защита на случай подключения «не тех» полюсов. Для этого можно сконструировать реле. Так, условная завязка базируется на диоде. Если перепутать плюс и минус, то он не будет пропускать ток. А поскольку на нём завязано реле, то оно будет обесточенным. Причем использовать данную схему можно с устройством, в основе которого и тиристоры, и транзисторы. Подключать её необходимо в разрыв проводов, с помощью которых сама зарядка соединяется с аккумулятором.
- Автоматика, которой должна обладать зарядка аккумулятора. Схема в данном случае должна гарантировать, что устройство будет работать только тогда, когда в этом действительно есть потребность. Для этого с помощью резисторов меняется порог срабатывания контролирующего диода. Считается, что аккумуляторы на 12 В являются полностью, когда их напряжение находится в рамках 12,8 В. Поэтому этот показатель является желанным для данной схемы.
Заключение
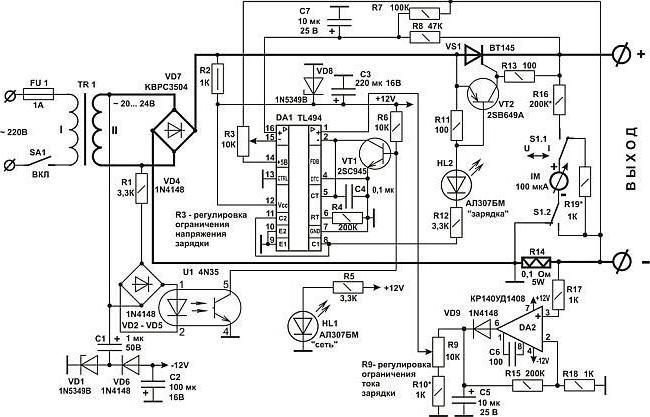 Вот мы и рассмотрели, что собой представляет зарядка аккумулятора. Схема данного устройства может быть выполнена и на одной плате, но следует отметить, что это довольно сложно. Поэтому их делают многослойными.
Вот мы и рассмотрели, что собой представляет зарядка аккумулятора. Схема данного устройства может быть выполнена и на одной плате, но следует отметить, что это довольно сложно. Поэтому их делают многослойными.В рамках статьи вашему вниманию были представлены различные принципиальные схемы, которые дают понять, как же, собственно, происходит зарядка аккумуляторов. Но необходимо понимать, что это только общие изображения, а более детальные, имеющие указания протекающих химических реакций, являются особенными для каждого типа батареи.