Характеристика cl: Дайте характеристику элемента Cl в периодической системе по плану а) порядковый номер, название,металл или неметалл. – Attention Required! | Cloudflare
- 05.06.2020
Свойства атома Хлора | |
Название | Хлор / Chlorum |
Символ | Cl |
Номер | 17 |
Атомная масса (молярная масса) | [35,446; 35,457] а. е. м. (г/моль) |
Электронная конфигурация | [Ne] 3s2 3p5 |
Радиус атома | 99 пм |
Химические свойства Хлора | |
Ковалентный радиус | 102±4 пм |
Радиус иона | (+7e)27 (-1e)181 пм |
Электроотрицательность | 3,16 (шкала Полинга) |
Электродный потенциал | 0 |
Степени окисления | 7, 6, 5, 4, 3, 1, 0, −1 |
Энергия ионизации (первый электрон) | 1254,9(13,01) кДж/моль (эВ) |
Термодинамические свойства простого вещества | |
Плотность (при н. у.) | 3,21 г/л; |
(жид. при −35 °C) 1,557 г/см3; | |
(тв. при −105 °C) 1,9 г/см3 | |
Температура плавления | 172,2К; −100,95 °C |
Температура кипения | 238,6К; −34,55 °C |
Критическая точка | 416,9 К, 7,991 МПа |
Уд. теплота плавления | 6,41 кДж/моль |
Уд. теплота испарения | 20,41 кДж/моль |
Молярная теплоёмкость | 21,838 Дж/(K·моль) |
Молярный объём | 18,7 см3/моль |
Кристаллическая решётка простого вещества | |
Структура решётки | орторомбическая |
Параметры решётки | a=6,29 b=4,50 c=8,21 Å |
Прочие характеристики Хлора | |
Теплопроводность | (300 K) 0,009 Вт/(м·К) |
Строение атома хлора (Cl), схема и примеры
Общие сведения о строении атома хлора
Относится к элементам p-семейства. Неметалл. Элементы-неметаллы, входящие в эту группу, носят общее название галогены. Обозначение – Cl. Порядковый номер – 17. Относительная атомная масса – 35,453 а.е.м.
Электронное строение атома хлора
Атом хлора состоит из положительно заряженного ядра (+17), состоящего из 17 протонов и 18 нейтронов, вокруг которого по 3-м орбитам движутся 17 электронов.
Рис.1. Схематическое строение атома хлора.
Распределение электронов по орбиталям выглядит следующим образом:
+17Cl)2)8)7;
1s22s22p63s23p5.
На внешнем энергетическом уровне атома хлора находится семь электронов, все они считаются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Наличие одного неспаренного электрона свидетельствует о том, что хлор способен проявлять степень окисления +1. Также возможно несколько возбужденных состояний из-за наличия вакантной 3d-орбитали. Сначала распариваются электроны 3p -подуровня и занимают свободные d-орбитали, а после – электроны 3s-подуровня:
Этим объясняется наличие у хлора ещё трех степеней окисления: +3, +5 и +7.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Хлор и его характеристики
Общая характеристика хлора
Важнейшим природным соединением хлора является хлорид натрия (поваренная соль) NaCl. Главная масса хлорида натрия находится в воде морей и океанов. Воды многих озер также содержат значительное количество NaCl. Он встречается также и в твердом виде, образуя местами в земной коре мощные пласты так называемой каменной соли. В природе распространены и другие соединения хлора, например хлорид калия в виде минералов карналлита KCl×MgCl2×6H2
В обычных условиях хлор представляет собой газ желто-зеленого цвета (рис. 1), который хорошо растворяется в воде. При охлаждении из водных растворов выделяются кристаллогидраты, являющиеся кларатами приблизительного состава Cl2×6H2Oи Cl2×8H2O.
Рис. 1. Хлор в жидком состоянии. Внешний вид.
Атомная и молекулярная масса хлора
Относительной атомной массой элемента называют отношение массы атома данного элемента к 1/12 массы атома углерода. Относительная атомная масса безразмерна и обозначается Ar (индекс «r» — начальная буква английского слова relative, что в переводе означает «относительный»). Относительная атомная масса атомарного хлора равна 35,457 а.е.м.
Массы молекул, также как массы атомов выражаются в атомных единицах массы. Молекулярной массой вещества называется масса молекулы, выраженная в атомных единицах массы. Относительной молекулярной массой вещества называют отношение массы молекулы данного вещества к 1/12 массы атома углерода, масса которого равна 12 а.е.м. Известно, что молекула хлора двухатомна – Cl2. Относительная молекулярная масса молекулы хлора будет равна:
Mr(Cl2) = 35,457 × 2 ≈ 71.
Изотопы хлора
Известно, что в природе хлор может находиться в виде двух стабильных изотопов 35Cl (75,78%) и 37Cl (24,22%). Их массовые числа равны 35 и 37 соответственно. Ядро атома изотопа хлора
Существуют искусственные изотопы хлора с массовыми числами от 35-ти до 43-х, среди которых наиболее стабильным является 36Cl с периодом полураспада равным 301 тысяча лет.
Ионы хлора
На внешнем энергетическом уровне атома хлора имеется семь электронов, которые являются валентными:
1s22s22p63s23p5.
В результате химического взаимодействия хлор может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
Cl0 –7e → Cl7+;
Cl0 -5e → Cl5+;
Cl0 -4e → Cl4+;
Cl0 -3e → Cl3+;
Cl0 -2e → Cl2+;
Cl0 -1e → Cl1+;
Cl0 +1e → Cl1-.
Молекула и атом хлора
Молекула хлора состоит из двух атомов – Cl2. Приведем некоторые свойства, характеризующие атом и молекулу хлора:
|
Энергия ионизации атома, эВ |
12,97 |
|
Сродство атома к электрону, эВ |
3,61 |
|
Относительная электроотрицательность |
3,0 |
|
Радиус атома, нм |
0,099 |
|
Стандартная энтальпия диссоциации молекул при 25oС, кДж/моль |
243 |
Примеры решения задач
Хлор — Вікіпедія
| Хлор (Cl) | |
|---|---|
| Атомний номер | 17 |
| Зовнішній вигляд простої речовини | Жовто-зелений їдкий газ, отруйний. |
| Властивості атома | |
| Атомна маса (молярна маса) | 35,4527 а.о.м. (г/моль) |
| Радіус атома | n/a пм |
| Енергія іонізації (перший електрон) | 1254,9(13,01) кДж/моль (еВ) |
| Електронна конфігурація | [Ne] 3s2 3p5 |
| Хімічні властивості | |
| Ковалентний радіус | 99 пм |
| Радіус іона | (+7e)27 (-1e)181 пм |
| Електронегативність (за Полінгом) | 3,16 |
| Електродний потенціал | 0 |
| Ступені окиснення | 7, 5, 3, 1, -1 |
| Термодинамічні властивості | |
| Густина | (при -33,6 °C)1,56 г/см³ |
| Молярна теплоємність | (Cl-Cl)0,477 Дж/(К·моль) |
| Теплопровідність | 0,009 Вт/(м·К) |
| Температура плавлення | 172,2 К |
| Теплота плавлення | (Cl-Cl)6,41 кДж/моль |
| Температура кипіння | 238,6 К |
| Теплота випаровування | (Cl-Cl)20,41 кДж/моль |
| Молярний об’єм | 18,7 см³/моль |
| Кристалічна ґратка | |
| Структура ґратки | орторомбічна |
| Період ґратки | 6,240 Å |
| Відношення с/а | n/a |
| Температура Дебая | n/a К |
 Хлор на Вікісховищі Хлор на Вікісховищі | |

Хлор (Cl) — елемент 7-ї групи періодичної таблиці хімічних елементів (за застарілою класифікацією — елемент головної підгрупи VII групи) з атомним номером 17[1].
Загальна характеристика[ред. | ред. код]
Позначається символом Cl (лат. Chlorum). Хімічно активний неметал. У природі існує два стабільних ізотопи: 35Cl i 37Cl. Науковцям вдалось синтезувати нестабільні ізотопи хлору, зокрема, з атомною масою 52[2][3].
Входить у групу галогенів (спочатку назву «галоген» використовував німецький хімік Швейгер для хлору [дослівно «галоген» перекладається як солерід], але воно не прижилося, і згодом стало загальним для VII групи елементів, у яку входить і хлор[4]).
Проста речовина хлор (CAS-номер: 7782-50-5) за нормальних умов — отруйний газ жовтувато-зеленого кольору важчий за повітря, з різким запахом. Молекула хлору двоатомна (формула Cl 2). Використовується як дезінфікуючий засіб, особливо у плавальних басейнах та у шкільних закладах.
Утворює кисневі кислоти хлору і міжгалогенні сполуки (ClF, ClF3, BrCl та інші).
Вперше хлор був отриманий у 1774 шведським хіміком К. Шеєле (Scheele), який отримав його при взаємодії піролюзиту з соляною кислотою:
- 4HCl + MnO 2 = Cl 2 + MnCl 2 + 2H 2O. Шеєле відзначив запах хлору, схожий із запахом царської води, його здатність взаємодіяти з золотом і кіновар’ю, а також його відбілюючі властивості та токсичність для комах. Однак Шеєле, відповідно до пануючої тоді в хімії теорії флогістону, припустив, що хлор є дефлогістованою соляною кислотою, тобто оксидом соляної кислоти. Бертолле та Лавуазьє припустили, що хлор є оксидом елемента мурія, але спроби відновити його вугіллям проведені Жозеф-Луї Гей-Люссаком закономірно залишалися марними. У 1810 р. англійський учений Г. Деві зміг електролізом розкласти кухонну сіль на натрій і хлор та довів, що цей газ є простою речовиною, а не оксидом. В своїй доповіді перед Королівським Товариством він назвав новий елемент хлор від грецького χλωρος (жовто-зелений).
Від грецького хлорос (грец. χλωρός) — «зелений».
Хлор досить поширений елемент. На нього припадає 0,04 % маси земної кори (Сер. вміст X. в земній корі 10−4% (мас.).). У вільному стані в природі він не зустрічається, оскільки в хімічному відношенні хлор дуже активний. Найважливіші мінерали хлору: галіт, сильвін, бішофіт, карналіт, хлорапатит, содаліт. Найпоширенішою природною сполукою хлору є хлорид натрію NaCl, величезні кількості якого розчинені у воді морів, океанів і деяких озер. У багатьох місцях хлорид натрію у вигляді мінералу галіту (або кам’яної солі) утворює потужні поклади. Багаті поклади дуже чистої кам’яної солі розташовані в районах м. Соль-Ілецька на південному Уралі і м. Бахмута на Донбасі.
Крім того, дуже поширеними сполуками хлору є хлорид калію KCl і хлорид магнію MgCl2. Хлорид калію і хлорид натрію утворюють мінерал сильвініт KCl · NaCl, потужні родовища якого розташовані в Україні (міста Калуш і Стебник), а хлорид калію і хлорид магнію утворюють мінерал карналіт KCl · MgCl2 · 6H2O, великі поклади якого є на Уралі (м. Солікамськ).
Хлор — важкий газ жовтувато-зеленого кольору з різким, задушливим запахом, неметал. При вдиханні дуже подразнює слизову оболонку і викликає гострий кашель, а у великих кількостях — навіть смерть.
Густина газоподібного хлору за нормальних умов 3,214, рідкого хлору при t кипіння — 1,557, твердого хлору — 1,9 (при t –102оС). tпл. — 101 оС; tкип. −34,6 оС.
Під тиском близько 6 атмосфер хлор уже при звичайній температурі скраплюється у жовту важку рідину, яка під нормальним тиском кипить при −34°С, а при −102,4°С замерзає в жовтувату кристалічну масу. Скраплений хлор зберігають і транспортують у стальних балонах.
У воді хлор розчиняється добре. В одному об’ємі води при звичайній температурі розчиняється понад два об’єми хлору. Розчин хлору в воді називають хлорною водою.
 Рідкий хлор у кварцовій ампулі.
Рідкий хлор у кварцовій ампулі.Хімічно дуже активний. Окиснювач. Утворює сполуки майже з усіма хімічними елементами. Хлор, маючи в зовнішньому електронному шарі сім електронів, його атоми легко віднімають валентні електрони від атомів інших елементів і перетворюються в негативно одновалентні іони Cl—. Цим самим проявляються його різко виражені окисні властивості. За своїми окисними властивостями хлор поступається лише перед фтором і приблизно рівноцінний кисню. Завдяки великому спорідненню його атомів до електрона, хлор безпосередньо сполучається з усіма металами і більшістю неметалів. Причому з багатьма металами він реагує дуже енергійно з виділенням тепла і світла. Наприклад, якщо в наповнений хлором циліндр внести розтертий в порошок стибій, він спалахує і згоряє, утворюючи густий білий дим трихлориду стибію (сурми) SbCl3:
Попередньо нагріті кальцій, залізо, мідь і інші метали теж енергійно згоряють в атмосфері хлору, утворюючи відповідні хлориди. Наприклад:
Запалений на повітрі червоний фосфор продовжує енергійно горіти в атмосфері хлору:
З воднем хлор теж реагує. Але при звичайній температурі реакція йде дуже повільно, а при нагріванні і під впливом сонячного світла — досить швидко і навіть з вибухом:
Реакції з органічними сполуками[ред. | ред. код]
Заміщення[ред. | ред. код]
При високій температурі хлор може віднімати водень від різних органічних сполук. Запалена свічка продовжує горіти в атмосфері хлору, виділяючи багато кіптяви, бо з хлором сполучається тільки водень, що входить до складу речовини свічки, а вуглець виділяється у вигляді кіптяви.
- CnH2n+2 + (n+1) Cl2 → n C+ (2n+2) HCl
Алкани реагують з хлором при нагріванні, реакція проходить по радикальному механізму
- CH3-CH3 + Cl2 → C2H6-xClx + HCl
Ароматичні сполуки реагують по іонному механізму, в присутності каталізаторів (напр. AlCl3, FeCl3):
- C6H6 + Cl2 → C6H5Cl + HCl
Кетони хлоруються набагато легше за відповідні алкани
- CH3-CH2-CO-CH2-CH3 + Cl2 -H+→ CH3-CHCl-CO-CH2-CH3 + HCl: CH3-CH2-CO-CH2-CH3 + 4Cl2 -OH—→ CH3-CCl2-CO-CCl2-CH3 + 4HCl
З метилекетонами реакція йде далі й відбувається розщеплення
- CH3-CO-CH3 — Cl2/-OH—→ CHCl3
Приєднання[ред. | ред. код]
Хлор приєднується по подвійному зв’язку алкенів
- CH2=CH2 + Cl2 → Cl-CH2-CH2-Cl
Окислення[ред. | ред. код]
Хлор — сильний окисник і рідко застосовується в цій якості. Він окисляє спирти (до кислот чи кетонів), альдегіди (до кислот).
- CH3-CH2-OH —Cl2 / OH—→ [CH3-CHO] →CHCl3
У лабораторних умовах хлор звичайно одержують взаємодією хлоридної кислоти HCl з двоокисом марганцю MnO2 (це також і перший промисловий метод одержання):
- 4HCl + MnO2 → MnCl2 + Cl2 ↑ + 2H2O
Mn4++2e=Mn2+Cl−−e=Cl−|{\displaystyle {\begin{matrix}Mn^{4+}+2e=Mn^{2+}\\\\Cl^{-}-e=Cl^{-}\end{matrix}}{\Bigg |}}
2.|{\displaystyle {\begin{matrix}\\2\\.\end{matrix}}{\Bigg |}}
12{\displaystyle {\begin{matrix}1\\\\2\end{matrix}}}
- Також застововують інші окисники:
- 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ +8H2O
- K2Cr2O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2O
Промислове виробництво[ред. | ред. код]
У техніці хлор одержують електролізом водного розчину хлориду натрію NaCl. Хлорид натрію у водному розчині дисоціює на іони натрію і хлору:
- NaCl←→Na++Cl−{\displaystyle NaCl\;{\overrightarrow {\leftarrow }}Na^{+}+Cl^{-}}
Молекули води також частково дисоціюють:
- h3O←→H++OH−{\displaystyle H_{2}O\;{\overrightarrow {\leftarrow }}H^{+}+OH^{-}}
Таким чином, до катоду притягуються катіони натрію і катіони водню, а до аноду — аніони хлору і аніони гідроксилу. Катіони водню відновлюються легше, ніж катіони натрію, а аніони хлору окиснюються легше, ніж аніони гідроксилу. Тому на катоді виділяється водень, а аноді — хлор. Електродні реакції можна позначити такими рівняннями:
- Катод: 2Н+ + 2е = Н2 ↑
- Анод: 2Cl— — 2е = Cl2 ↑
Катіони натрію і аніони гідроксилу весь час нагромаджуються в розчині і утворюють гідроксид натрію NaOH. Він реагує з хлором, що частково розчиняється в воді, утворюючи гіпохлорит та хлорид натрію
- NaOH + Cl2 → NaCl + NaOCl
Розчин NaClO використовують як відбілювач (в Україні виробляється під назвою «Білизна») Якщо проводити гідроліз в апараті де катодний та анодний простір розділені напівпроникною мембраною то реакції хлонру з гідроксидом натрію не відбувається, що дозволяє отримати окрім хлору чистий гідроксид натрію.
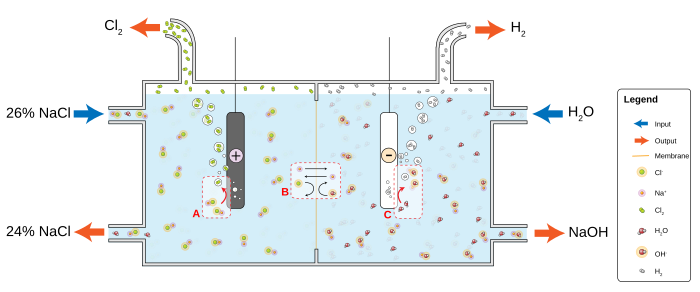 Електроліз хлориду натрію мембранним способом
Електроліз хлориду натрію мембранним способомУ техніці хлор застосовується дуже широко. Використовують у виробництві хлорорганічних сполук (напр., вінілхлориду, хлоропренового каучуку, дихлоретану та ін.), барвників, лікарських та інших речовин, для вибілювання тканини, паперу, дезінфекції тощо.
Значні кількості його використовують для виробництва
- хлоридної кислоти HCl,
- хлорного вапна Ca(OCl)Cl
- Застосування хлору для знезараження (хлорування) питної води в наш час[коли?] намагаються обмежити й замінити озонуванням, але на сьогодні воно є основним в більшості країн, в тому числі Україні.
- В металургії хлор застосовують для хлорування руд для одержання цілого ряду кольорових і рідкісних металів — титану, ніобію, танталу і інших — у вигляді їх хлоридів, з яких потім електролізом добувають чисті метали.
Багато хлору споживає хімічна промисловість для одержання різних хлорорганічних сполук, які використовують для боротьби з шкідниками і бур’янами в сільському господарстві, а також для виготовлення різних барвників, синтетичного каучуку, пластмас тощо. Найвідомішими з них є:
Отруйний. Г. Д.К. в повітрі виробничих приміщень 1 мг/м3, в атмосфері населених пунктів одноразова (короткотривала) — 0,1 мг/м3, середньодобова — 0,003 мг/м3.
Хлор Cl,характеристика Хлора,роль Хлора в организме человека
- Подробности
- Просмотров: 2245
Чем же так полезен Хлор? Данный макроэлемент помогает нашему организму правильно функционировать и поддерживает многие химические процессы, протекающие в нем. Оказывает влияние на важный процесс регуляции водного баланса. Давайте разберемся подробнее во всех его полезных свойствах.
Польза Хлора:
Преимущественно, большая концентрация Хлора сосредоточена в нашей крови, кожном покрове, а также в межклеточной жидкости и костных тканях. Данное условие обусловлено тем, что соединения Хлора имеют свойство быть растворимыми в воде.
- Позволяет устранить отечность
- Принимает участие в регуляции осмотических процессов
- Участвует в процессе передачи нервных импульсов
- Участвует в водно — солевом обмене
- Оказывает влияние на гибкость тела
- Улучшает аппетит
- Удерживает жидкость в организме
- Улучшает и поддерживает работу печени
- Присутствует в составе желудочного сока
- Способствует процессу расщепления жиров
- Выводит из организма углекислый газ
- Положительно влияет на эритроциты
- Участвует в поддержании рН — кислотности клеток
Хлор принимает участие в пищеварительном процессе, помогая вырабатывать желудочный сок. Стоит отметить то, что, при повышенной кислотности, поступление Хлора в организм должно быть увеличено. Если у человека наблюдаются различные заболевания ЖКТ — это сопровождается нехваткой Хлора.
Суточная потребность в Хлоре:
- Взрослые: 4 — 6 гр/сутки
- Груднички: нужное количество Хлора поступает с молоком матери
Симптомы дефицита Хлора:
- Истощение организма
- Частые запоры
- Заболевания зубов
- Ухудшение состояния волос
- Отечность
- Гипотония и гипертония
- Нарушение кислотно — щелочного баланса организма
Симптомы передозировки Хлора:
- Чувство рези в глазах
- Обильное слезотечение
- Сухой кашель
- Боль в области груди
- Головные боли
- Повышение температуры тела
- Возможный отек легких
Взаимодействие Хлора с другими веществами:
Вместе с Натрием Na и Калием K участвует в процессе регулирования кислотно — щелочного и водного баланса организма
Источники Хлора:
Основным источником Хлора Cl для нашего организма можно назвать обычную, поваренную соль.
Растительные:
Животные:
Макроэлемент Хлор позволяет нам поддерживать наше здоровье, а также защищать его от различных недугов. обратите внимание на данный элемент и его свойства — возможно в вашем питании не хватает именно его?
Добавить комментарий
Галогены. Элементы VIIA-группы. Хлор, фтор. Конспект по химии
Галогены. Элементы VIIA-группы. Хлор, фтор
Ключевые слова: галогены, VIIA-группа, хлор, фтор, бром, йод, характеристика элемента, строение галогенов, получение хлора.
Раздел ОГЭ: 3.1.2. Химические свойства простых веществ-неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния
Галогены (от греч. hals – соль и лат. genui – рождать, т. е. «рождающие соли») — это элементы VIIA-группы – фтор F, хлор Cl, бром Вг, йод I. Электронная конфигурация валентного слоя атомов галогенов в стационарном состоянии ns2np5. Радиусы атомов галогенов от фтора к йоду увеличиваются, энергия ионизации и электроотрицательности уменьшается, неметаллические свойства ослабляются.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ХЛОР
Хлор Cl – элемент № 17, в Периодической системе химических элементов Д. И. Менделеева находится в 3–м периоде, в VIIA группе. Электронная конфигурация атома хлора в стационарном состоянии 1s22s22p63s23p5: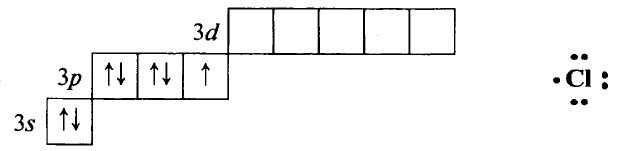
В своих соединениях хлор проявляет валентности:
Наиболее характерными степенями окисления хлора являются следующие:
Высший оксид хлора – оксид хлора (VII) Cl2О7 – кислотный оксид, высшим гидроксидом хлора является хлорная кислота НСlO4 (сильная кислота).
Водородное соединение хлора – хлороводород НCl (газ при обычных условиях), его водный раствор – соляная кислота, сильный электролит.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ФТОР
Фтор F – элемент № 9, находится во 2–м периоде, в VIIA группе. Электронная конфигурация внешнего электронного атома фтора 1s22s22p5: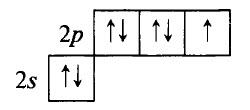
В атоме фтора нет вакантных орбиталей на втором энергетическом уровне для перехода атома в возбуждённое состояние. Переход на вакантные орбитали третьего энергетического уровня потребовал бы слишком больших затрат энергии, следовательно, фтор может быть только одновалентен.
Электроотрицательность фтора среди других элементов максимальна (∼4,0 по шкале Полинга). Следовательно, для фтора невозможны положительные степени окисления. Возможные степени окисления фтора: 0 (F2) и –1 (HF, KF и т. д.).
СТРОЕНИЕ ГАЛОГЕНОВ – ПРОСТЫХ ВЕЩЕСТВ
Галогенам не присуща аллотропия, каждому элементу – галогену (Hal) соответствует одно простое вещество Наl2. Галогены – вещества молекулярного строения.
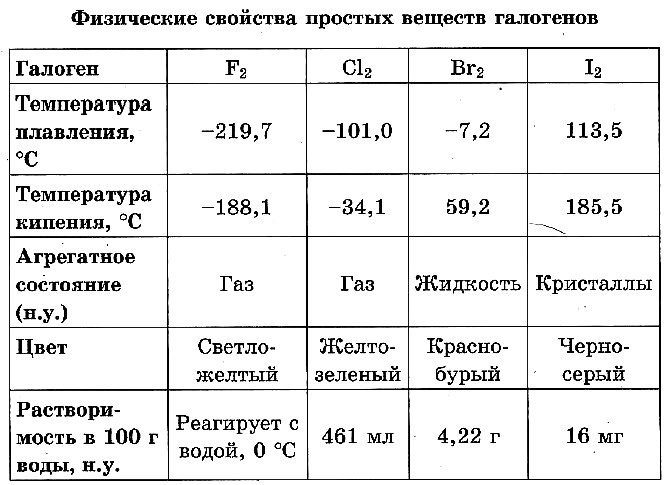
При обычных условиях фтор F2 – зеленовато–жёлтый газ; хлор Cl2 – жёлто–зелёный газ; бром Вг2 – красно–бурая жидкость, примерно в 3 раза тяжелее воды; йод I2 – фиолетово–чёрные кристаллы с металлическим блеском. Все галогены обладают характерным запахом.
Хлор, бром, йод умеренно растворимы в воде, их растворы называются соответственно хлорной, бромной и йодной водой (фтор с водой реагирует).

ПОЛУЧЕНИЕ ХЛОРА
В промышленности хлор получают электролизом расплава поваренной соли.
Лабораторные способы получения хлора основаны на окислении хлора в соляной кислоте с помощью таких окислителей, как перманганат калия, дихромат калия или диоксид марганца. Приведём примеры этих реакций:

Конспект урока по химии «Галогены. Элементы VIIA-группы. Хлор, фтор «. Выберите дальнейшее действие:
Характеристика элементов
- Решебники
- База знаний
- База знаний
- Характеристика элементов
| Название | Знак | |
|---|---|---|
| Водород | H | Водород H |
| Литий | Li | Литий Li |
| Бериллий | Be | Бериллий Be |
| Бор | B | Бор B |
| Углерод | C | Углерод C |
| Азот | N | Азот N |
| Кислород | O | Кислород O |
| Фтор | F | Фтор F |
| Натрий | Na | Натрий Na |
| Магний | Mg | Магний Mg |
| Алюминий | Al | Алюминий Al |
| Кремний | Si | Кремний Si |
| Фосфор | P | Фосфор P |
| Сера | S | Сера S |
| Хлор | Cl | Хлор Cl |
| Калий | K | Калий K |
| Кальций | Ca | Кальций Ca |
| Скандий | Sc | Скандий Sc |
| Титан | Ti | Титан Ti |
| Ванадий | V | Ванадий V |
| Марганец | Mn | Марганец Mn |
| Железо | Fe | Железо Fe |
| Кобальт | Co | Кобальт Co |
| Никель | Ni | Никель Ni |
| Цинк | Zn | Цинк Zn |
| Галлий | Ga | Галлий Ga |
| Германий | Ge | Германий Ge |
| Мышьяк | As | Мышьяк As |
| Селен | Se | Селен Se |
| Бром | Br | Бром Br |
| Рубидий | Rb | Рубидий Rb |
| Стронций | Sr | Стронций Sr |
| Иттрий | Y | Иттрий Y |
| Цирконий | Zr | Цирконий Zr |
| Технеций | Tc | Технеций Tc |
| Кадмий | Cd | Кадмий Cd |
| Индий | In | Индий In |
| Олово | Sn | Олово Sn |
| Сурьма | Sb | Сурьма Sb |
| Теллур | Te | Теллур Te |
| Иод | I | Иод I |
| Цезий | Cs | Цезий Cs |
| Барий | Ba | Барий Ba |
| Гафний | Hf | Гафний Hf |
| Тантал | Ta | Тантал Ta |
| Вольфрам | W | Вольфрам W |
| Ртуть | Hg | Ртуть Hg |
| Таллий | Tl | Таллий Tl |
| Свинец | Pb | Свинец Pb |
| Висмут | Bi | Висмут Bi |
| Полоний | Po | Полоний Po |
| Астат | At | Астат At |
